
- •Лекция №3 Химия белков
- •Заменимые
- •Глицин аланин
- •Моноаминомонокарбоновые: глицин, аланин, валин, лейцин, изолейцин.
- •Полностью заменимыми являются восемь аминокислот: аланин, аспартат, аспарагин, глутамат, глутамин, серин, глицин и пролин.
- •Биологическая роль незаменимых аминокислот
- •Природные пептиды разделяются на несколько групп в зависимости от выполняемых ими функций.
Лекция №3 Химия белков
Химия аминокислот. Классификация, свойства аминокислот.
Формы связей аминокислот в белковой молекуле, значение их в формировании молекулы белка и её свойств
Важнейшие заменимые и незаменимые аминокислоты, пептиды их роль в организме. Роль аминокислот в практической медицине.
-1-
Аминокислоты – мономеры белков. Аминокислоты – это аминопроизводные класса карбоновых кислот, они входят не только в состав белков, многие из них выполняют специальные функции.
Физико-химические и биологические свойства белков определяются их аминокислотным составом. По биологической значимости аминокислоты разделяют на
Заменимые
незаменимые.
Известно 20 аминокислот, которые входят в состав природных белков. Аминокислоты живых организмов кодируются генетическим кодом, их называют протеиногенные, их 20, 19 из них являются α-аминокислотами, т.е. группа -NН2- присоединена к α-углеродному атому тех карбоновых кислот, производными которых они являются. Исключение составляет пролин – аминокислота, она не соответствует общей формуле аминокислот:
СН2-СООН СН3-СН-СООН
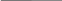

NН2 NН2
Глицин аланин
По строению соединений, получающихся при расщеплении углеродной цепи аминокислоты в организме, различают:
глюкопластичные (глюкогенные) – при недостаточном поступлении углеводов или нарушении их превращения они через щавелевоуксусную или фосфоэнолпировиноградную кислоты превращаются в глюкозу или гликоген. К этой группе относятся глицин, аланин, серин, треонин, Валин, аспарагиновая и глутаминовая кислота, аргинин, гистидин и метионин;
кетопластичные (кетогенные) – ускоряют образование кетоновых тел – лейцин, изолейцин, тирозин и фенилаланин (три последние могут быть и глюкогенными).
По структуре аминокислоты разделяют на 2 группы:
ациклические – аминокислоты предельного ряда;
циклические – аминокислоты ароматического ряда.
А. По количеству функциональных групп различают ациклические аминокислоты:
Моноаминомонокарбоновые: глицин, аланин, валин, лейцин, изолейцин.
Моноаминомонокарбоновые – в молекуле каждой из них имеется одна амино- и одна карбоксильная группа, в водном растворе дает нейтральную среду.
Глицин - Участвует в образовании нуклеиновых кислот, желчных кислот, гема, необходим для обезвреживания в печени токсических веществ.
Аланин - Участвует в процессах обмена углеводов и энергии. Его изомер β-аланин является составной частью витамина пантотеновой кислоты (В5), коэнзима А (КоА), экстрактивных веществ мышц.
Гидроксилсодержащие: треонин, серин.
Серин - Входит в состав различных ферментов, основного белка молока – казеина, обнаружен в составе липопротеидов и других белков.
Серусодержащие: цистин, метионин
Цистеин - Благодаря группе -SН- цистеин окисляется и защищает организм при лучевом поражении, отравлении фосфором.
Метионин - Содержит группу -СН3, которая используется для синтеза важных соединений – холина, креатина, Тимина, адреналина и др.
Моноаминодикарбоновые: глутаминовая и аспаргиновая кислоты.
моноаминодикарбоновые кислоты – имеют одну амино- и 2 карбоксильных группы, в водном растворе дают кислую среду. К ним относят
аспарагиновую кислоту и глутаминовую кислоту
Эти аминокислоты участвуют в биосинтезе белка, образовании тормозных медиаторов (переносчик нервных возбуждений) нервной системы, энергетическом обмене.
Диаминомонокарбоновые: аргинин, лизин
диаминомонокарбоновые кислоты – имеют две амино- и одну карбоксильную группу, в водном растворе дают щелочную среду. К ним относят лизин
и аргинин
Лизин участвует в синтезе белка, обнаружен в составе некоторых ферментов. Аргинин участвует в синтезе мочевины, креатина, который входит в состав мышц и участвует в обмене энергии.
Б. Циклические аминокислоты имеют в составе ароматическое или гетероциклическое ядро, незаменимые, должны поступать с пищей. Активно участвуют в разнообразных обменных процессах.
Ароматические: фенилаланин, тирозин.
Фенилаланин - Основной источник синтеза тирозина – предшественник гормонов тироксина, адреналина, некоторых пигментов.
Гетероциклические: триптофан, пролин, оксипролин, гистидин
Тирозин - Участвует в синтезе адреналина, тироксина.

 Триптофан
- Участвует
в синтезе белка, используется для синтеза
витамина РР, серотонина, гормонов
эпифиза, ряда пигментов.
Триптофан
- Участвует
в синтезе белка, используется для синтеза
витамина РР, серотонина, гормонов
эпифиза, ряда пигментов.
Гистидин - Участвует в синтезе белка, предшественник гистамина, влияющего на кровяное давление, секрецию желудочного сока.
-2-
Аминокислота представляет собой производное органической кислоты, в котором водород в α-положении замещен на аминогруппу (-NH2). Например, из уксусной кислоты образуется глицин, а из пропионовой - аланин. В аминокислотах одновременно присутствуют и кислотная и основная группы (карбоксил —СООН и аминогруппа —NH2), они относятся к амфотерным соединениям.
Присутствующие в клетке свободные аминокислоты образуются в результате расщепления белков или поступления из межклеточной жидкости. Свободные аминокислоты составляют так называемый аминокислотный фонд, из которого клетка черпает строительные блоки для синтеза новых белков.
Связь R—NH—СО—R называется пептидной связью. Образующаяся молекула также является амфотерной, поскольку на одном ее конце всегда находится кислая группа, а на другом - основная; боковые цепи (остатки аминокислот) могут быть основными или кислыми. Пептидные связи образуются при взаимодействии α-аминогруппы одной аминокислоты с α-карбоксильной группой другой аминокислоты. Пептидная связь – амидная ковалентная связь, соединяющая аминокислотные остатки в цепочку. Следовательно, пептиды – это цепочки аминокислот.
Аминокислоты могут объединяться в длинные цепи, образуя между собой пептидные связи. Две аминокислоты при этом образуют дипептид и т.д. Пептиды содержащие до 10 аминокислот называют олигопептидами, а до 50 – полипептидами, а если больше, чем 50 аминокислот, то уже – белками.
Химические и физико-химические свойства аминокислот обусловлены функциональными группами с противоположными свойствами. Поэтому в водном растворе аминокислоты существуют в виде равновесной смеси биполярного иона, катионной и анионной форм молекулы. Равновесие зависит от рН среды.
NН3+-СН-СООН ↔NН3+-СН-СОО¯ ↔ NН2-СН-СОО¯
R R R
катионная форма биполярный ион анионная форма
кислая среда ←← рН→→ щелочная среда
Нейтральные аминокислоты в воде не имеют заряда.
Кислые аминокислоты (дикарбоновые) обе их карбоксильные группы диссоциируют, отдавая 2 протона, но поскольку у них только одна аминогруппа, принимающая один протон, то такие аминокислоты ведут себя как кислоты и раствор имеет кислую реакцию. Возникающий при этой диссоциации ион имеет избыток отрицательного заряда.
Основные аминокислоты реагируют в водном растворе как слабые основания. Это связано с тем, что один протон, который освобождается при диссоциации карбоксильной группы таких аминокислот, связывается с одной из аминогрупп, а вторая аминогруппа связывает протон из водного окружения, увеличивая тем самым количество ОН-групп и повышая рН. Заряд иона таких аминокислот положительный.
При добавлении в раствор аминокислот дополнительного количества протонов (кислоты) подавляется диссоциация карбоксильных групп и увеличивается количество NН3+-групп. Аминокислоты при этом переходят в катионную форму (приобретают положительный заряд). При добавлении щелочи улучшаются условия для диссоциации карбоксильных групп – аминокислоты переходят в анионную форму ( приобретают отрицательный заряд). Изменяя таким образом рН раствора, можно изменять заряд молекул аминокислот. В зависимости от свойств аминокислот количество добавляемой кислоты или щелочи для изменения величины заряда будет разным. При определенном для каждой аминокислоты значении рН наступает такое состояние, при котором заряд аминокислоты становится нейтральным. Такое значение рН получило название изоэлектрической точки (рJ). При значении рН, равном изоэлектрической точке, аминокислоты не перемещаются в электрическом поле. При рН ниже изоэлектрической точки катион аминокислоты движется к катоду, а при рН выше рJ анион аминокислоты движется к аноду. На этих свойствах аминокислот основана возможность их разделения в электрическом поле (электрофорез). Кислые аминокислоты имеют рJ в слабокислой среде, основные – в слабоосновной, а нейтральные – в нейтральной.
-3-
Для синтеза белков и других биохимических реакций организм использует исключительно аминокислоты, а не белки, поступающие с пищей. Некоторые аминокислоты, необходимые для роста и нормального функционирования животных организмов, потребляются готовыми из пищи, так как скорость их синтеза отстает от скорости расхода. Такие аминокислоты называются незаменимыми аминокислотами. К ним относятся валин, лейцин, изолейцин, фенилаланин, аргинин, треонин, метионин, лизин, триптофан, гистидии.
