
- •Рецензент:
- •Введение
- •Лабораторная работа №1 Правила безопасности при работе в лаборатории общей химии. Элементы техники лабораторных работ. Весы и взвешивание.
- •1.1 Техника безопасности при работе в лаборатории общей химии
- •1.2 Помощь при несчастных случаях
- •1.3 Правила обращения с реактивами
- •1.4 Химическая посуда и оборудование. Элементы техники лабораторных работ
- •1.4.1 Весы и взвешивание
- •1.4.2 Правила обращения с весами
- •1.4.3 Взвешивание цинка на аналитических весах
- •1.5 Необходимый уровень подготовки студентов
- •1.6 Вопросы для самоконтроля
- •Лабораторная работа №2 Основные классы неорганических соединений: оксиды, основания и амфотерные гидроксиды
- •2.1 Теоретические пояснения
- •2.2 Методика проведения опытов
- •2.2.1Оксиды их получение и свойства
- •2.2.2 Гидроксиды, их получение и свойства
- •2.2.2.2 Опыт 2 Получение нерастворимого основания
- •Необходимый уровень знаний студентов
- •Уметь писать уравнения реакций, отражающие химические свойства оксидов и гидроксидов.
- •Задания для самоконтроля
- •Лабораторная работа №3 Основные классы неорганических соединений: кислоты и соли
- •3.1 Теоретические пояснения
- •3.2 Методика проведения опытов
- •3.2.1 Кислоты, их получение и свойства
- •3.2.2 Соли, их получение и свойства
- •3.2.2.5 Опыт 5 Получение солей взаимодействием двух солей
- •3.3 Необходимый уровень знаний студентов
- •3.3.4 Уметь писать уравнения реакций, отражающие химические свойства оксидов, гидроксидов, солей. Знать условия протекания до конца реакций ионного обмена
- •3.4 Задания для самоконтроля
- •Лабораторная работа №4 Определение молярной массы эквивалента цинка
- •4.1 Теоретические пояснения
- •4.2 Методика проведения опытов
- •4.2.1 Обработка результатов опыта
- •4.3 Примеры решения задач
- •4.4 Необходимый уровень знаний студентов
- •4.5 Задания для самоконтроля
- •Лабораторная работа №5 Кинетика химических реакций
- •5.1 Теоретические пояснения
- •5.2 Методика проведения опытов
- •5.3 Примеры решения задач
- •5.4 Необходимый уровень знаний студентов
- •5.5 Задания для самоконтроля
- •Лабораторная работа №6 Химическое равновесие
- •6.1 Теоретические пояснения
- •6.2 Методика проведения опытов
- •6.3 Примеры решения задач
- •6.4 Необходимый уровень знаний студентов
- •6.5 Задания для самоконтроля
- •Лабораторная работа №7 Приготовление растворов заданной концентрации
- •7.1 Теоретические пояснения
- •7.2 Методика проведения опытов
- •7.3 Примеры решения задач
- •7.4 Необходимый уровень знаний студентов
- •7.5 Задания для самоконтроля
- •Лабораторная работа №8 Малорастворимые электролиты. Произведение растворимости
- •8.1 Теоретические пояснения
- •8.2 Методика проведения опытов
- •8.3 Необходимый уровень знаний студентов
- •8.4 Задания для самоконтроля
- •Литература
- •Содержание
- •Пашаян арарат александрович
- •Методические указания по выполнению лабораторных работ
3.3.4 Уметь писать уравнения реакций, отражающие химические свойства оксидов, гидроксидов, солей. Знать условия протекания до конца реакций ионного обмена
3.4 Задания для самоконтроля
3.4.1 Составьте формулы средних и кислых бариевых солей следующих кислот: H2SO4; H2S; H3PO4; H2SO3; H2C2O4; H2Cr2O7. Назовите эти соли.
Изобразите графические формулы следующих солей: MgSO3; Ca(HCO3)2; Na2HPO4; (CuOH)2SO4; (CuOH)2CO3; KaAl(SO4)2; KFe[Fe(CN)6]. Назовите эти соли.
Определите класс и назовите соли: Al(OH)Cl2; (CuOH)2CO3; Bi(OH)2NO3; ZnOHCl; Ca3(PO4)2; CaHPO4; Ca(H2PO4)2.
Назовите следующие соли железа и напишите их графические формулы: Fe2(SO4)3; FeOHCl; [Fe(OH)]2SO4; FeHPO4’ FeOHSO4.
Составьте формулы следующих солей: дигидрофосфат кальция, гидрокарбонат кальция, сульфат гидроксоалюминия, сульфит бария, сульфид бария, гидросульфид бария.
Составьте формулы всех кальциевых солей фосфористой кислоты и назовите их.
Лабораторная работа №4 Определение молярной массы эквивалента цинка
Цель работы: познакомиться с понятием химического эквивалента, определить молярную массу химического эквивалента цинка методом вытеснения водорода.
Оборудование и реактивы: прибор для определения молярной массы эквивалента металла (см. рис. 1), термометр, барометр, 25%-ный раствор соляной кислоты, металлический цинк.
4.1 Теоретические пояснения
Химическим эквивалентом (Э) называется реальная или условная частица вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим способом эквивалентна (равноценна) одному иону водорода в кислотно-основных и обменных реакциях, либо одному электрону в окислительно-восстановительных реакциях.
Реальные частицы - это атомы, ионы, молекулы и т.д., а условные частицы - это, например, 1/2 (H2SO4), 1/4( С), 1/3( Fe3+).
В общем случае эквивалент любого вещества X может быть записан в виде ЭХ =1/z(X), где z - число эквивалентности, или эквивалентное число, которое всегда > 1. Оно показывает, сколько эквивалентов содержится в одной формульной единице вещества.
Для данного вещества z находится по конкретной реакции. В окислительно-восстановительных процессах z определяется числом электронов, принятых или отданных одной формульной единицей вещества, например, в реакции:
Mg + 2HCl → MgCl2 + H2
Z(Mg)=2, т.к. магний в ходе окислительно-восстановительной реакции отдает 2 электрона, а ЭMg =½ (Mg). В обменных процессах Z определяется стехиометрией и равно знаменателю правильной дроби, которая получается при делении коэффициента перед веществом на самый большой коэффициент в реакции:
АI2O3 + 6HCI =2AICI3 +3H2O
Z
(АI2O3)
= 6, т.к. при делении коэффициента перед
АI2O3
на
самый большой коэффициент в реакции -
6, получается правильная дробь
![]() ,
знаменатель которой равен 6; Z(HCI)
=
1, т.к. при делении коэффициента перед
HCI
на самый большой коэффициент в реакции
- 6, получается 1.
,
знаменатель которой равен 6; Z(HCI)
=
1, т.к. при делении коэффициента перед
HCI
на самый большой коэффициент в реакции
- 6, получается 1.
Когда речь не идет о конкретной реакции, при определении z для сложных веществ можно воспользоваться следующими правилами:
1) для оксидов z равно числу атомов элемента, умноженному на степень окисления элемента;
2) для кислот z равно основности кислоты;
3) для оснований z равно кислотности основания;
4) для солей z равно числу катионов металла, умноженному на заряд катиона.
Количество вещества эквивалента обозначается vЭ, единица измерения - моль. Один моль эквивалента вещества содержит 6,022-1023 эквивалентов.
Молярная масса эквивалента MЭ - это масса 1 моль эквивалентов вещества, измеряется в г/моль.
Связь между молярной массой эквивалента, количеством вещества эквивалента, массой и молярной массой вещества выражается соотношениями:
![]()
![]() (4.1)
(4.1)
Экспериментальное определение молярной массы химического эквивалента цинка в данной работе основано на законе эквивалентов:
Вещества
реагируют друг с другом в равных
количествах эквивалентов
![]() .
(
4.2)
.
(
4.2)
Из закона эквивалентов следует, что массы реагирующих друг с другом веществ, а также массы продуктов реакции относятся друг к другу как молярные массы их эквивалентов:
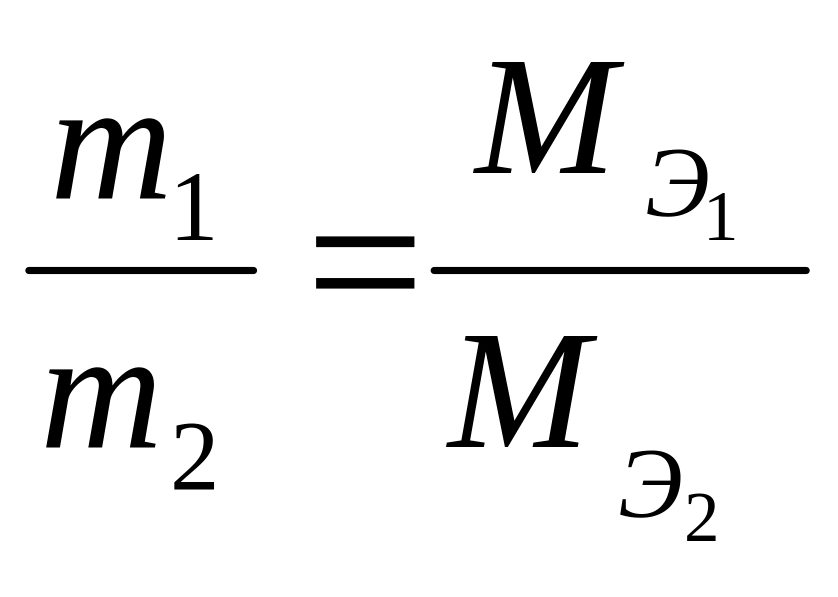 (4.3)
(4.3)
Если
вещество находится в газообразном
состоянии то для него справедливы
соотношения:![]() ;
;
![]() ;
где
;
где
![]() –
количество вещества эквивалента; V–
объем газообразного вещества в данных
условиях;
–
количество вещества эквивалента; V–
объем газообразного вещества в данных
условиях;
![]() –
молярный объем эквивалента вещества в
тех же условиях; VM
–
молярный объем вещества; Z–
число эквивалентности.
–
молярный объем эквивалента вещества в
тех же условиях; VM
–
молярный объем вещества; Z–
число эквивалентности.
На основе закона эквивалентов можно вывести следующие формулы для вычисления молярных масс эквивалентов сложных веществ:
Моксида
M1/z оксида = _______________________________________, (4.4)
Число атомов элемента · Валентность элемента
Mкислоты
М1/z кислоты = _____________________, (4.5)
Основность кислоты
Моснования
М1/z основания = ____________________, (4.6)
Кислотность основания
Мсоли
М1/z соли = ______________________________________. (4.7)
Число атомов металла · Валентность металла
