
- •Рецензент:
- •Введение
- •Лабораторная работа №1 Правила безопасности при работе в лаборатории общей химии. Элементы техники лабораторных работ. Весы и взвешивание.
- •1.1 Техника безопасности при работе в лаборатории общей химии
- •1.2 Помощь при несчастных случаях
- •1.3 Правила обращения с реактивами
- •1.4 Химическая посуда и оборудование. Элементы техники лабораторных работ
- •1.4.1 Весы и взвешивание
- •1.4.2 Правила обращения с весами
- •1.4.3 Взвешивание цинка на аналитических весах
- •1.5 Необходимый уровень подготовки студентов
- •1.6 Вопросы для самоконтроля
- •Лабораторная работа №2 Основные классы неорганических соединений: оксиды, основания и амфотерные гидроксиды
- •2.1 Теоретические пояснения
- •2.2 Методика проведения опытов
- •2.2.1Оксиды их получение и свойства
- •2.2.2 Гидроксиды, их получение и свойства
- •2.2.2.2 Опыт 2 Получение нерастворимого основания
- •Необходимый уровень знаний студентов
- •Уметь писать уравнения реакций, отражающие химические свойства оксидов и гидроксидов.
- •Задания для самоконтроля
- •Лабораторная работа №3 Основные классы неорганических соединений: кислоты и соли
- •3.1 Теоретические пояснения
- •3.2 Методика проведения опытов
- •3.2.1 Кислоты, их получение и свойства
- •3.2.2 Соли, их получение и свойства
- •3.2.2.5 Опыт 5 Получение солей взаимодействием двух солей
- •3.3 Необходимый уровень знаний студентов
- •3.3.4 Уметь писать уравнения реакций, отражающие химические свойства оксидов, гидроксидов, солей. Знать условия протекания до конца реакций ионного обмена
- •3.4 Задания для самоконтроля
- •Лабораторная работа №4 Определение молярной массы эквивалента цинка
- •4.1 Теоретические пояснения
- •4.2 Методика проведения опытов
- •4.2.1 Обработка результатов опыта
- •4.3 Примеры решения задач
- •4.4 Необходимый уровень знаний студентов
- •4.5 Задания для самоконтроля
- •Лабораторная работа №5 Кинетика химических реакций
- •5.1 Теоретические пояснения
- •5.2 Методика проведения опытов
- •5.3 Примеры решения задач
- •5.4 Необходимый уровень знаний студентов
- •5.5 Задания для самоконтроля
- •Лабораторная работа №6 Химическое равновесие
- •6.1 Теоретические пояснения
- •6.2 Методика проведения опытов
- •6.3 Примеры решения задач
- •6.4 Необходимый уровень знаний студентов
- •6.5 Задания для самоконтроля
- •Лабораторная работа №7 Приготовление растворов заданной концентрации
- •7.1 Теоретические пояснения
- •7.2 Методика проведения опытов
- •7.3 Примеры решения задач
- •7.4 Необходимый уровень знаний студентов
- •7.5 Задания для самоконтроля
- •Лабораторная работа №8 Малорастворимые электролиты. Произведение растворимости
- •8.1 Теоретические пояснения
- •8.2 Методика проведения опытов
- •8.3 Необходимый уровень знаний студентов
- •8.4 Задания для самоконтроля
- •Литература
- •Содержание
- •Пашаян арарат александрович
- •Методические указания по выполнению лабораторных работ
4.3 Примеры решения задач
Пример 1
На восстановление 7,09 г оксида двухвалентного металла требуется 2,24 л водорода, измеренного при (н.у.). Вычислить молярные массы металла и оксида. Чему равна относительная масса металла?
Решение:
По закону
эквивалентов массы веществ m1
и m2,
вступающих в реакцию, пропорциональны
молярным массам их эквивалентов
![]() (4.3)
(4.3)
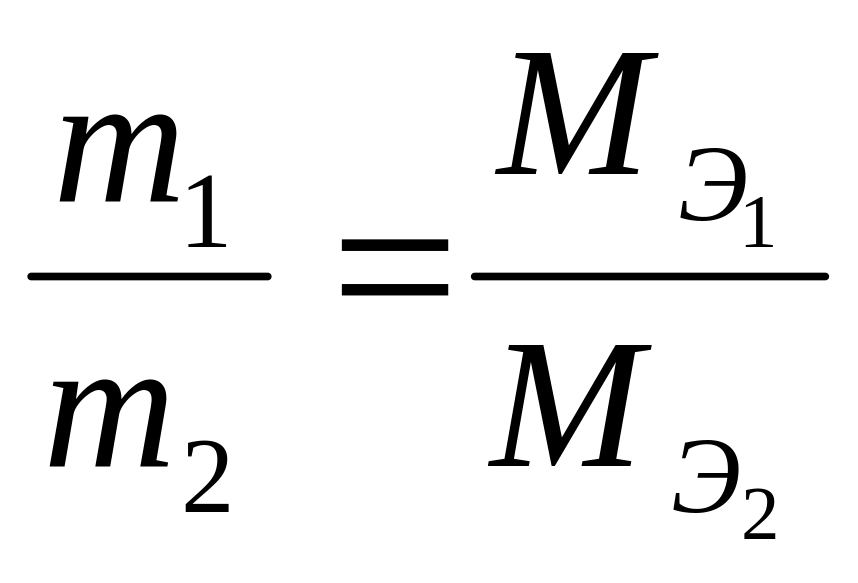 ;
(1)
;
(1)
![]() (2)
(2)
Если одно из веществ находится в газообразном состоянии, то как правило, его количество измеряется в объемных единицах (см3, л, м3).
Формулу (2) преобразуем относительно объема водорода:
![]()
Находим молярную массу эквивалента металла:
![]()
По закону эквивалентов:

Относительную атомную массу металла определяем из соотношения:
![]()
![]()
Пример 2
Определить молярную массу эквивалента Fe2(SO4)3 в реакции ионного обмена: Fe2(SO4)3 + 6NaOH = 2 Fe(OH)3 + 3 Na2SO4.
Решение:
По
стехиометрии реакции Z
частицы Fe2(SO4)3
равно 6, т.
к. при делении коэффициента перед
Fe2(SO4)3
получается правильная дробь
,
знаменатель которой равен 6. Так как
![]() ,
то молярная масса эквивалента сульфата
железа (Ш)
в данной реакции может быть вычислена
по формуле
,
то молярная масса эквивалента сульфата
железа (Ш)
в данной реакции может быть вычислена
по формуле
МЭ(Fe2(S04)3) = M(Fe2(SO4)3) /6 = 400/6 = 66,7 (г/моль).
4.4 Необходимый уровень знаний студентов
4.4.1 Знать понятия: эквивалент, число эквивалентности, количество вещества эквивалента, молярная масса эквивалента.
4.4.2 Уметь выражать связь между молярной массой эквивалента, количеством вещества эквивалента, массой и молярной массой вещества.
4.4.3 Знать закон эквивалентов, уметь применять его для нахождения масс и молярных масс веществ, участвующих или образующихся в реакции.
4.4.4 Уметь определять молярную массу эквивалента элемента, эквивалент и молярную массу эквивалента вещества в реакции.
4.5 Задания для самоконтроля
4.5.1 Когда количество вещества эквивалента равно количеству вещества?
4.5.2 Определить молярную массу эквивалента Fe(OH)2Cl в реакциях: a) Fe(OH)2Cl + NaOH = Fe(OH)3 + NaCl; 6) Fe(OH)2Cl + 2HCl = FeCl3 + 2 H2O.
4.5.3 Почему молярная масса элемента постоянна, а молярная масса его эквивалента может изменяться?
4.5.4 Может ли молярная масса эквивалента элемента или вещества быть больше его молярной массы и почему?
4.5.5 Почему при расчетах масс реагентов по молярным массам их эквивалентов не нужно знать значения коэффициентов в уравнении реакции?
4.5.6 Найти массу алюминия, если при его полном растворении в кислоте выделяется такое же количество водорода, что и при растворении 1,752 г цинка. Молярная масса эквивалента цинка равна 32,69 г/моль, молярная масса эквивалента алюминия - 8,99 г/моль.
4.5.7 Для нейтрализации кислоты гидроксидом калия на ее 1,866 г потребовалось 15 г гидроксида калия, молярная масса эквивалента которого равна 56 г/моль. Вычислите молярную массу эквивалента кислоты.
Лабораторная работа №5 Кинетика химических реакций
Цель работы: изучение скорости химической реакции и ее зависимости от различных факторов: природы реагирующих веществ, концентрации, температуры .
Оборудование и реактивы: химический стакан, термометр, штатив с пробирками, электроплитка, лучина, дистиллированная вода, 0,1М раствор НС1, 1,0 н, раствор H2SO4, 0,05 н раствор Na2S2O3, мел.
