
- •И. В. Целинскии, и. В. Шугалей, с.Ф.Мельникова кинетика реакций нитросоединений
- •1 . СПб Госуниверситет кино и телевидения, л.Л.Кузнецов,
- •Введение
- •1 Основы формальной кинетики
- •1.1 Скорость химической реакции
- •1.2 Закон действия масс
- •Например, для реакции образования трис-(оксиметил)нитрометана
- •1.3 Реакции простых типов
- •Е сли выражение для скорости принимает вид
- •1.4 Константа скорости реакции
- •1.5 Уравнение Аррениуса
- •1.6 Нулевой порядок реакции
- •1.7 Понятие псевдопорядка реакции
- •1.8 Кинетика гетерофазных реакций в системе жидкость-жидкость
- •1.9 Методы определения констант скоростей и порядков химических реакций
- •Обратимые реакции
- •Р ассмотрим обратимую реакцию
- •1.11 Параллельные реакции
- •1.12 Последовательные реакции
- •Подставив (1.26) в (1.24), придем к выражению
- •Последовательные реакции с обратимыми стадиями Принцип стационарного состояния
- •Приравнивая выражения (1.30) и (1.31), имеем
- •Подставляя уравнение (1.37) в выражение (1.36), получим
- •2. Основы теории абсолютных скоростей реакции
- •2.1. Поверхность потенциальной энергии
- •2.2 Теория абсолютных скоростей реакций
- •2.3 Термодинамическая формулировка скоростей реакций
- •2.4 Истинная энергия активации
- •2.5 Кинетический изотопный эффект
- •Рассмотрим киэ в случае бимолекулярной реакции
- •2.6 Изотопный эффект среды и эффекты атомов «тяжелых» элементов
- •Литература
- •Оглавление
- •Текст лекций Кинетика реакций нитросоединеннй
- •Светлана Федоровна Мельникова
- •190013, Московский пр., 26, Санкт-Петербург, Россия
1.9 Методы определения констант скоростей и порядков химических реакций
Существуют два основных метода определения констант скоростей и порядков химических реакций: интегральный и дифференциальный.
Интегральный метод. В интегральном методе константа скорости реакции выражается через концентрации реагирующих частиц. В случае реакции первого порядка, например, превращения псевдонитролов в нитроловые кислоты
![]()
в начальный момент t = 0, [B]o = 0, [А]о = а; во время t=τ [В] = х, [А] = а-х.
Тогда выражение для скорости процесса имеет вид
![]()
Разделяя переменные и интегрируя, получаем
![]() .
.
Отсюда -
ln a = c,
и в итоге
получаем
![]() (1.11)
(1.11)
После преобразований уравнения (1.11) получим экспоненциальное выражение для текущей концентрации продукта реакции
![]()
Исходя из выражения (1.11) константу скорости реакции можно легко определить графически (рис.1.3). Прямая, приведенная на рис.1.3, называется полулогарифмической анаморфозой кинетической кривой. Константа скорости реакции, исходя из выражения (1.11), может быть определена как тангенс угла наклона прямой 2 на рис. 1.3.
![]() Наряду с константой
скорости для характеристики процесса
часто используется полупериод реакции.
Полупериодом реакции τ1/2
называется время, за которое половина
реагента превращается в продукт реакции.
Для реакции первого порядка имеем:
Наряду с константой
скорости для характеристики процесса
часто используется полупериод реакции.
Полупериодом реакции τ1/2
называется время, за которое половина
реагента превращается в продукт реакции.
Для реакции первого порядка имеем:
Для реакции второго порядка A+B→C рассматриваем простейший случай, когда [А]о = [В]о.
В начальный момент t=0, [А]о = [В]о = а, [С]о=0; во время t=τ [А]=[В]= а—х, [С]=x.
Тогда
![]()
Разделяя переменные и интегрируя, получим при условии t=0; x=0:
![]()
И![]() сходя
из этого выражения, константу скорости
реакции второго порядка можно вычислить
из графика, приведенного на рис. 1.4, как
тангенс угла наклона прямой 2.
Выражение для расчета полупериода
реакции второго порядка имеет вид
сходя
из этого выражения, константу скорости
реакции второго порядка можно вычислить
из графика, приведенного на рис. 1.4, как
тангенс угла наклона прямой 2.
Выражение для расчета полупериода
реакции второго порядка имеет вид

.
Рисунок 1.3 - Кинетическая кривая расходования реагента А (1) и ее полулогарифмическая анаморфоза (2 ) для реакции первого порядка
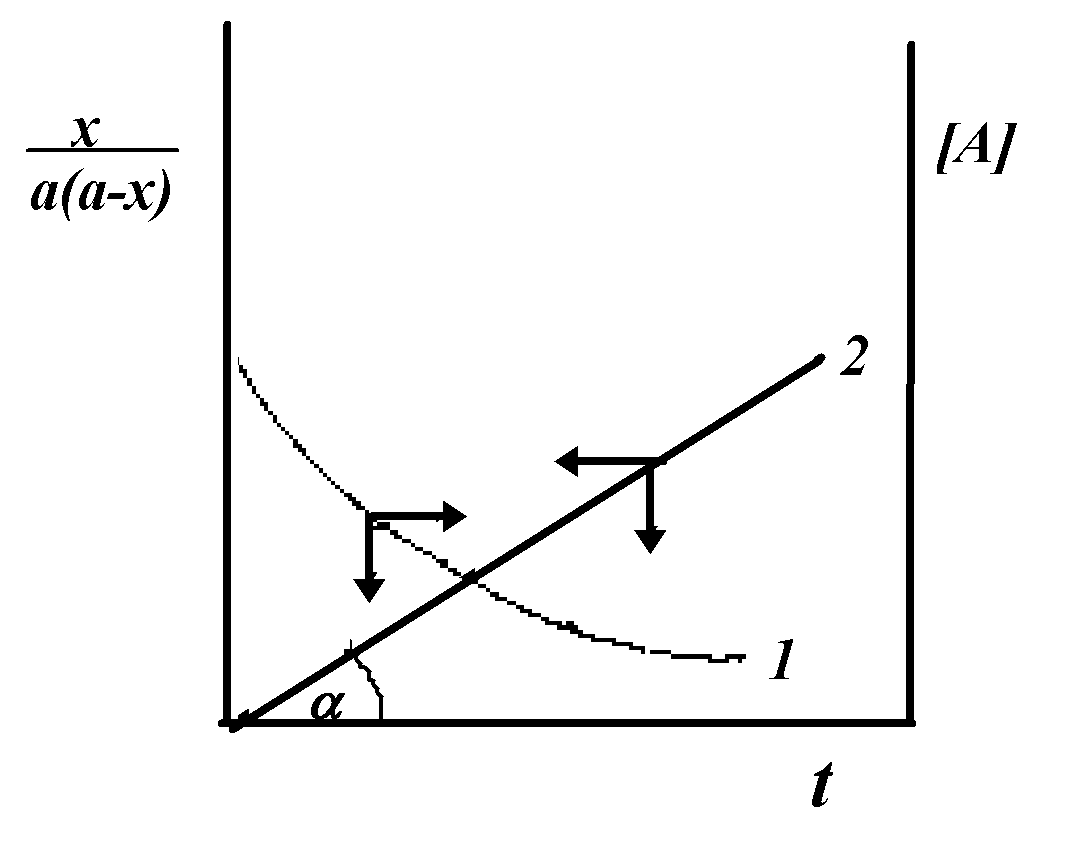
Рисунок 1.4 - Кинетическая кривая (1) )реакции второго порядка и ее анаморфоза (2)
Дифференциальный метод. Дифференциальный метод определения порядка скоростей химических реакций был предложен Вант-Гоффом.

Рисунок 1.5 - Графическое определение
порядка и константы скорости реакции
Для реакции
n-го
порядка уравнение скорости реакции
можно записать в виде
![]()
Прологарифмировав данное уравнение, получим :
![]()
На основании выражения (1.12) можно определить константу скорости и порядок реакции графически (рис.1.5). Для этого находят начальную скорость процесса как угловой коэффициент касательных к кинетическим кривым при нескольких начальных концентрациях реагента и строят график, аналогичный представленному на рис.1.5. Отрезок, отсекаемый на оси ординат, равен логарифму константы скорости процесса, а тангенс угла наклона прямой к оси абсцисс численно равен порядку реакции.
Рассчитанный таким способом порядок реакции называется концентрационным, или истинным.
Для
расчета порядка реакции можно использовать
одну кинетическую кривую, а мгновенные
скорости процесса определять как угол
наклона касательных к кривой c=f(t)
при
различных значениях времени реакции
t.
Далее
построение графика в координатах
![]() дает прямую линию с угловым коэффициентом
, равным порядку реакции (рис.1.5). В отличие
от метода начальных скоростей, данный
способ расчета позволяет определить
т.н. временной порядок реакции, который
может отличаться от концентрационного
в случае сложных реакций, например, если
промежуточные продукты катализируют
процесс (автокаталитические процессы)
дает прямую линию с угловым коэффициентом
, равным порядку реакции (рис.1.5). В отличие
от метода начальных скоростей, данный
способ расчета позволяет определить
т.н. временной порядок реакции, который
может отличаться от концентрационного
в случае сложных реакций, например, если
промежуточные продукты катализируют
процесс (автокаталитические процессы)

[NO2]*105,моль/л
|
Рисунок 1.6 - Кинетические кривые распада NO2 по реакции: 2NO2→2NO + O2
1— [NO2]o = 18.10-5 моль/л; 2— [NO2]o = 9.10-5 моль/л
Например, для реакции распада NO2 по уравнению 2 NO2→2 NO + O2 (рис. 1.6) тан-
генс угла наклона прямой в координатах уравнения (1.12) равен 1,98 (см. рис.1.7), т.е. порядок реакции практически равен 2. Используя соотношение (1.12) и метод начальных скоростей, можно получить величину концентрационного, или истинного порядка реакции. При определении порядка по методу, представленному на рис.1.7, мы получаем временной порядок реакции.

Рисунок 1.7 - Зависимость скорости распада NO2 от концентрации NO2 по ходу реакции, рассчитанная по данным рис. 1.6 (кривая 1)
