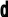5. Квантові числа
Основні положення квантової механіки.
Енергія випромінюється і поглинається тілами окремими порціями – квантами. Отже, енергія мікрочастинок змінюється стрибкоподібно.
Електрони та інші мікрочастинки мають двоїсту природу: з одного боку, вони виявляють властивості в частинок (наприклад мають масу і заряд), з іншого боку під час руху вони мають властивості електромагнітних хвиль.
Квантова механіка заперечує наявність певних орбіт у мікрочастинок. Для електронів, що рухаються, неможливо визначити точне місцезнаходження. Вони перебувають у просторі поблизу атомного ядра. Можна лише визначити ймовірність перебування електрона в різних частинках простору (напр.. атому водню).

а) електрона хмара в) гранична поверхня
Простір поблизу
ядра, в якому досить велика ймовірність
перебування електрона(![]() 90%),
називається орбіта ллю.
90%),
називається орбіта ллю.
Цей простір обмежується поверхнею, т.б. є об’ємною геометричною фігурою.
О рбіта
лі часто зображають квадратом 1 .
рбіта
лі часто зображають квадратом 1 .
Стан електрона в атомі можна описати за допомогою 4 квантових чисел.
Електрони в атомах
мають не однакову енергію і відповідно
до своєї енергії розміщуються на різних
рівнях від ядра. Утворюючи енергетичні
рівні, або електроні шари. Енергетичний
рівень визначається головним квантовим
число n,
яке може мати цілі значення: 1,2,3,4…..![]() .
Найбільше значення n
(n
=1) відповідає енергетичному рівню з
найнижчою енергією, із збільшенням n
енергія рівня зростає.
.
Найбільше значення n
(n
=1) відповідає енергетичному рівню з
найнижчою енергією, із збільшенням n
енергія рівня зростає.
Енергетичні рівні позначать арабськими цифрами відповідно до значень n: n=1, рівень (або шар K ); n=2, рівень другий(або шарL); n=3; рівень 3 (або шар M)…
Якщо атом перебуває основному (не збудженому ) стані, то число електронних шарів дорівнює номеру періоду, в якому перебуває даний елемент у періодичній системі. Напр. Cl (3-й період) – значить електрони перебувають на 3 енергетичних рівнях.
Орбіта лі в атомах мають певну форму, яка характеризує значення орбітального квантового числа l. Значення l залежить від головного квантового числа: l набуває цілих значень від 0 до n-1. якщо n=1, то l=0, при n=2, l набуває двох значень: 0 і 1.
Формам орбіта лей присвоєно буквені позначення s.p.d.f…… Значення l=0 відповідає s – орбіталі, якщо l=1, то це p – орбіталі, що мають форму гантелі:






а) б)
Якщо l=2 або l=3 відповідають d і f – орбіталі (мають складну форму).
Отже, електрони, що відповідають першому енергетичному рівню, перебувають тільки на s – орбіталях, електрони 2 рівня на s і p орбіталях, електрони 3 рівня – на s,p,d – орбіталях, тощо… В межах одного шару електрони з однаковими знач. ё утворюють підрівні(або підшари).
Головне квантове число |
Підрівні(кількість) |
Орбітальне квантове число |
підрівні |
n=1 |
Один підрівень |
l=0 |
s-підрівень |
n=2 |
Два підрівня |
l=0 l=1 |
s- підрівень p- підрівень |
n=3 |
Три підрівня |
l=0 l=1 l=2 |
s- підрівень p- підрівень d- підрівень |
n=4 |
Чотири підрівня |
l=0 l=1 l=2 l=3 |
s- підрівень p- підрівень d- підрівень f- підрівень |
Магнітне квантове число m визначає розміщення орбіталі в просторі. Його значення залежить від l: m може набувати цілих значень від –l до +l, включаючи 0.
Якщо l=0, то m=0, отже s – орбіталі мають тільки одне положення в просторі(мал.а).
Для l=1 існують три значення магнітного квантового числа: -1,0; +1. Їм відповідають три взаємно перпендикулярні p – орбіталі (мал.б).
Отже, в межах одного енергетичного рівня може бути одна s і три p – орбіталі.
Головне квантове число |
Орбітальне квантове число |
Магнітне кантове число |
n=1 |
l=0 |
m=0 |
n=2 |
l=0 |
m=0 |
l=1 |
m=-1 m=0 m=+1 |
|
n=3 |
l=0 |
m=0 |
l=1 |
m=-1 m=0 m=+1 |
|
l=2 |
m=-2 m=-1 m=0 m=+1 m=+2 |
|
n=4 |
l=0 |
m=0 |
l=1 |
m=-1 m=0 m=+1 |
|
l=2 |
m=-2 m=-1 m=0 m=+1 m=+2 |
|
l=3 |
m=-3 m=-2 m=-1 m=0 m=+1 m=+2 m=+3 |
Для кожного енергетичного підрівня число орбіта лей, які складають цей підрівень дорівнює 2l+1.
s – підрівень – склад з однієї s – орбіталі;
p- підрівень – склад з трьох p – орбіта лей;
d- підрівень – склад з п’яти d – орбіта лей;
f- підрівень – склад з семи f – орбіта лей;
К

 рім
квантових чисел n,l,m,
що описують рух електрона поблизу ядра
атома існує спінове квантове число
S,яке
характеризує два можливі напрямки
обертання електронів навколо власної
осі. Спінове квантове число набуває
двох значень: +1/2 і -1/2 орбіталь з двома
електронами, що мають різні значення S
(антипаралельні спіни), зображують так
рім
квантових чисел n,l,m,
що описують рух електрона поблизу ядра
атома існує спінове квантове число
S,яке
характеризує два можливі напрямки
обертання електронів навколо власної
осі. Спінове квантове число набуває
двох значень: +1/2 і -1/2 орбіталь з двома
електронами, що мають різні значення S
(антипаралельні спіни), зображують так
Принцип Паулі: В атомі не може бути двох електронів, всі чотири квантові числа яких були б однаковими. Звідси виходить, що на одній орбіталі може бути не більше двох електронів.
Пр. Паулі визначає
число електронів на електричних рівнях
і підрівнях. Число електронів на
енергетичному рівні N
дорівнює:![]() ,
де n
– головне квантове число.
,
де n
– головне квантове число.
Графічно можна образити так:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
||||||||||||||
|
|
|||||||||||||||||

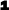
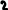

Звідси випливає, що на першому енергетичному рівні може перебувати 2 електрони, на 2-8,на3-18,на 4-32.
У багатоелектронних атомах електрони розміщуються в навколоядерному просторі в послідовності поступового підвищення енергії. Енергія підрівнів зростає в міру збільшення головного квантового числа n та орбітального квантового числа l.
Відомий російський учений В. М. Клечковський запропонував два прості правила, згідно з якими відбувається заповнення енергетичних підрівнів електронами.
У міру збільшення заряду ядра атома послідовне заповнення електронних орбіталей починається від орбіталей з меншим значенням суми головного та орбітального квантових чисел (n + l) до орбіталей з більшим значенням цієї суми (перше правило Клечковського).
У разі однакових значень суми (n + l) заповнення орбіталей відбувається послідовно в міру збільшення значення головного квантового числа n (друге правило Клечковського).
Під час вивчення хімічних властивостей елементів та їх здатності утворювати хімічні зв’язки користуються спрощеним схематичним зображенням атомів або їхніх зовнішніх енергетичних підрівнів, що забудовуються. У разі, коли на підрівні число електронів менше за граничне і можна по-різному їх розмістити, використовують правило Гунда:
на підрівнях електрони розміщуються так, щоб сума їхніх спінових квантових чисел була максимальною.
Енергія іонізації атомів. (І)
Це енергія, необхідна для того, щоб відправити електрон від не збудженого атома, тобто енергія.
Процесу
![]() ,
де Е – це хім.. елемент.
,
де Е – це хім.. елемент.
Енергія іонізації вимірюється в електронах – вольтах(еВ). Енергія іонізації пов’язана з положенням елементів у періодичній системі. Енергія іонізації в середині підгрупи зменшується із збільшенням порядкового номеру. Енергія іонізації характеризує металічні й не металічні властивості елементи. Металічні властивості зумовлені рухливістю електронів. Чим менша енергія іонізації, тим типовіші металічні властивості виявляє елемент. Тому можна сказати, що в підгрупах з верху вниз відбувається посилення металічних властивостей елементів. У періодах зліва на право металічні властивості послаблюються .
Спорідненість до електрону.
Енергія яка
виділяється чи поглинається при приєднані
електронів до електронегативного не
збудженого атому наз. спорідненістю до
електрону.
![]() К/моль (еВ/ат
К/моль (еВ/ат![]() ).
).
У головних підгрупах
із зростанням порядкового номеру
спорідненість до електрону зменшується
![]()
![]() .
.
Напр. якщо атом
вже має структуру![]() ,
особливо
,
особливо
![]() - то спорідненість до електрона буде
низькою.
- то спорідненість до електрона буде
низькою.
Електронегативність.
Енергія іонізації характеризує здібність атому втрачати електрон, спорідненість до електрону характеризує здібність атому зміщувати у свій бік електрон, при утворені зв’язку ввели таке поняття, як Електронегативність атому.
Електронегативністю
наз. півсуму енергію іонізації(І) та
споріненісю(F)
даного елементу
![]() К/моль.
К/моль.
Електронегативність характеризує здатність атому притягувати до себе валентні електрони.
Як будь-які фіз. властивості атому Електронегативність елементів закономірно змінюється із зростанням порядкового номеру, характер закономірності – періодичні.
У періодах для елементів головних підгруп електронег. зростає із збільшенням (s-ел.), порядкового номера т.б. починається період найменшої Електронегативністю, а закінчується (p-ел 7гр) – найбільш електор.
Що стосується p елемент 8гр (гелій, аргон) – то електронег. дуже низька, бо хоч ці елементи мають найвищу енергію іонізації, але ж мають дуже низьку спорідненість до електронів, тому по формулі півсума цих величин дуже мала. Якщо розглядати періодичну систему в цілому то найбільш електронег. елементи знаходяться в правому верхньому кутку (фтор, кисень, азот, сірка , фосфор).
Найменш електронегативні елементи в лівому нижньому кутку.
Металічні елементи мають такі загальні характеристики: низькі значення енергії іон., низькі значення спорідненості до електрону H (еме)- навпаки, висока (І), висока (F), як наслідок висока (X).
Li Be B C N O F
0.98 1.57 2.09 2.55 3.04 3.44 3.98
Дослідження будови атомів показали, що найважливіший і найстійкішою характеристикою атома є позитивний заряд ядра.
Тому сучасне формулювання періодичного закону Д.І. Менделєєва таке:
Властивості хім.. елем. та їх сполук перебувають у періодичні залежності від заряду ядер атомів елементів.
Отже, дослідження будови атомів створили наукову основу періодичного закону.