
- •Е. И. Степановских, л. А. Брусницына, т. А. Алексеева физическая химия Примеры решения задач
- •Рекомендации по оформлению решений
- •2. Способы линеаризации опытных данных.
- •Термодинамические свойства простых веществ и соединений
- •3. Расчет изменений энтропии, энтальпии и энергии гиббса чистого вещества
- •5. Расчеты экстенсивных свойств системы с химическим превращением. Химическое равновесие
- •6. Фазовые равновесия
- •6.1. Фазовые равновесия в однокомпонентных системах
- •6.2. Фазовое равновесие в двухкомпонентных системах
- •Приложения
- •Часть 1
- •620002, Екатеринбург, Мира, 19
Е. И. Степановских, л. А. Брусницына, т. А. Алексеева физическая химия Примеры решения задач

УДК 544(076)
Составители: Е. И. Степановских, Л. А. Брусницына, Т. А. Алексеева
Научный редактор доц., канд. хим. наук В. И. Двойнин
Физическая химия. Примеры решения задач : методические указания по курсу физической химии. В 2 ч. Ч.1 / сост. Е. И. Степановских, Л. А. Брусницына, Т. А. Алексеева. Екатеринбург : УрФУ, 2012. 71 с.
Методические указания являются дополнением к имеющимся учебникам и предназначены для самостоятельной работы над курсом физической химии.
Библиогр.: 3 назв. Табл. 9. Рис. 12. Прил. 3.
Подготовлено кафедрой физической и коллоидной химии
© Уральский федеральный
университет, 2012
ОСНОВНЫЕ ОБОЗНАЧЕНИЯ И ПОНЯТИЯ
Давление (p). Единицы измерения [p] = атм; бар; Па.
1 атм = 1,013105 Па. 1 бар = 1,0105 Па.
Объем (V). [V] = л; м3; см3.
1 л = 1000 мл = 103 см3 = 103 м3 ; 1 см3 = 1106 м3.
Температура (Т) в шкале Кельвина. [T] = К.
Температура (t) в шкале Цельсия. [t] = оС.
1 К = 273,15 + оС
Масса (m). [m] = кг; г. 1 кг = 1000 г.
Число молей (n ). [n] = моль.
Теплоемкость системы (С ). [C] = Дж/К.
Изобарная
теплоемкость системы
(![]() ).
[Cp]
= Дж/К.
).
[Cp]
= Дж/К.
Изохорная теплоемкость системы (Cv). [Cv] = Дж/К.
Мольная
изобарная теплоемкость системы (![]() ).
).
[![]() ]
= Дж/(Кмоль).
]
= Дж/(Кмоль).
Мольная
изохорная теплоемкость системы
(![]() ).
).
[ ] = Дж/(Кмоль).
Удельный объем
чистого вещества
(![]() ).
[
]
= м3/кг.
).
[
]
= м3/кг.
Мольный объем
чистого вещества (![]() ).
[
]
= м3/моль.
).
[
]
= м3/моль.
Плотность
массы чистого вещества (ρо).
[![]() о]
= кг/м3
.
о]
= кг/м3
.
Работа (A). [A] = Дж.
Количество теплоты ( Q). [Q] = Дж.
Энтропия (полная, всей системы) (S). [S] = Дж/К.
Мольная энтропия (s). [s] = Дж/(мольК) .
Внутренняя энергия (U). [U] = Дж.
Мольная внутренняя энергия (u). [u] = Дж/моль.
Энтальпия (полная, всей системы) (Н). [H] = Дж.
Мольная энтальпия (h). [h] = Дж/моль.
Энергия Гиббса (G). [G] = Дж .
Мольная энергия Гиббса (g). [g] = Дж/моль.
Мольная доля компонента k (Nk).
Массовая доля компонента k (φk).
Мольный объем
(![]() ).
[
]
= м3/моль.
).
[
]
= м3/моль.
Удельный объем ( уд). [ уд] = м3/кг.
Парциальный
мольный объем компонента k
(![]() ).
).
[ ] = м3/моль.
Глубина
химической реакции (кси)(![]() ).
).
Стехиометрическое
число компонента k
в реакции (![]() ).
).
Стандартная
мольная энтальпия реакции
(![]() ).
).
Стандартная мольная энтальпия образования вещества k
(![]() ).
).
Стандартная
мольная энтропия реакции (![]() ).
).
Стандартная
мольная энтропия вещества
k
(![]() ).
).
Стандартная мольная изобарная теплоемкость реакции r
(![]() ).
).
Константа
равновесия реакции r
в pшкале (![]() ).
).
Уравнение состояния идеального газа системы невзаимодействующих частиц точечного размера;
![]() ,
(А)
,
(А)
где n количество вещества (в молях);
R универсальная газовая постоянная,
R = 8,314 Дж/(мольК) = 1,987 кал/(мольК) = 0,0821 латм/(мольК).
Нормальные условия это температура 0 оС и давление 1 атм.
Первый закон (первое начало) термодинамики:
энергия изолированной системы постоянна −
![]() .
.
В неизолированной системе энергия может изменяться за счет:
а) совершения системой работы над окружающей средой;
б) теплообмена системы с окружающей средой.
Математическая формулировка первого закона для закрытых систем:
dU = Q A ; U = Q A. (Б)
Буквы в уравнении (Б) отражают тот факт, что Q и A не являются функциями состояния, они служат формами передачи энергии и связаны с процессами, а не с состояниями системы. Их называют также функциями перехода и бесконечно малое изменение теплоты и работы не является полным дифференциалом.
Теплота может переходить в систему при нагревании. Для расчета теплоты используют понятие теплоемкости (С)
![]() ,
(В)
,
(В)
где
![]()
бесконечно малое количество теплоты,
сообщенное системе для изменения ее
температуры на
бесконечно малое количество теплоты,
сообщенное системе для изменения ее
температуры на
![]() .
Теплоемкость
экстенсивное свойство. Теплоемкость
зависит от природы вещества, его
агрегатного состояния, от температуры.
На
рисунке показана в общем виде зависимость
мольной изобарной теплоемкости вещества
от температуры.
.
Теплоемкость
экстенсивное свойство. Теплоемкость
зависит от природы вещества, его
агрегатного состояния, от температуры.
На
рисунке показана в общем виде зависимость
мольной изобарной теплоемкости вещества
от температуры.
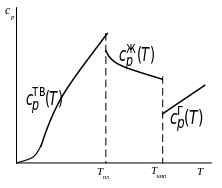
Зависимость изобарной
теплоемкости вещества
от температуры
Эта зависимость получается при подстановке произвольных значений температуры в эмпирически наблюдаемые и приведенные в справочной литературе температурные ряды
![]() ,
(Г)
,
(Г)
где
![]()
эмпирические коэффициенты.
эмпирические коэффициенты.
При температуре
системы, меньшей чем температура
плавления (Т
< Т
пл),
температурная зависимость теплоемкости
вещества
![]() имеет вид
имеет вид
![]() .
(Д)
.
(Д)
При температуре, находящейся в интервале от температуры плавления до температуры кипения (T пл <Т < Т кип), вещество будет в жидком состоянии и температурная зависимость теплоемкости будет следующей:
![]() .
(Е)
.
(Е)
И, наконец, при температуре системы выше температуры кипения вещества (T кип <Т), когда вещество находится в газообразном виде, зависимость теплоемкости от температуры имеет вид:
![]() .
(Ж)
.
(Ж)
Для идеальных газов мольная теплоемкость практически не зависит от температуры и равна:
для одноатомных идеальных газов = 3/2 R;
двухатомных идеальных газов = 5/2 R;
нелинейных трехатомных и многоатомных молекул = 3 R.
Для идеальных газов справедливо уравнение Майера
![]() .
(И)
.
(И)
Экспериментально обнаружено, что внутренняя энергия идеального газа не зависит ни от объема, ни от давления, т.е.
![]() и
и
![]() .
.
Второй
закон термодинамики устанавливает
критерии необратимости термодинамических
процессов: существует
функция состояния
энтропия
S,
которая
обладает следующим свойством
![]() ,
причем знак равенства относится к
обратимым процессам, а знак больше
к необратимым.
,
причем знак равенства относится к
обратимым процессам, а знак больше
к необратимым.
Для изолированных систем второй закон утверждает, что энтропия изолированных систем в необратимых процессах может только возрастать, а в состоянии термодинамического равновесия она достигает максимума (dS = 0).
В отличие от многих других термодинамических функций, энтропия имеет точку отсчета, которая задается постулатом Планка: при абсолютном нуле T = 0 К все идеальные кристаллы имеют одинаковую энтропию, равную нулю.
