
Типовые задачи и их решения
Пример 1. На основании данных, приведенных в табл. 1, определить, является ли потенциал кадмия равновесным во всем интервале исследованных концентраций раствора.
Таблица 1 - Значения потенциала кадмия в растворах СdCl2 при 25°С.
сСdCl2, М |
10-7 |
10-6 |
10-5 |
3·10-5 |
10-4 |
10-3 |
10-2 |
10-1 |
1 |
ЕСd, В |
-0,54 |
-0,54 |
-0,54 |
-0,54 |
-0,52 |
-0,50 |
-0,48 |
-0,46 |
-0,45 |
Р е ш е н и е. Для решения вопроса, является ли потенциал кадмия в растворе его ионов равновесным, следует сопоставить теоретический и опытный вид зависимости ЕСd = f(lg aCd2+).
Рассчитываем
логарифм активности ионов кадмия в
исследованных растворах, используя
значения коэффициентов активности
СdCl2,
принимая: M
= m;
![]() ≈
1 для
≈
1 для
![]() <
0,0001. Данные сведены в таблицу 2.
<
0,0001. Данные сведены в таблицу 2.
Таблица 2 - Результаты расчета логарифма активности ионов кадмия
сСdCl2, М |
10-7 |
10-6 |
10-5 |
3·10-5 |
10-4 |
10-3 |
10-2 |
10-1 |
1 |
g |
1 |
1 |
1 |
1 |
0,943 |
0,819 |
0,524 |
0,228 |
0,066 |
аСd2+ = m γ |
10-7 |
10-6 |
10-5 |
3·10-5 |
9,43 × 10-5 |
8,19 × 10-4 |
5,24 × 10-3 |
2,28 × 10-2 |
0,066 |
Lg aCd2+ |
-7 |
-6 |
-5 |
- 4,52 |
- 4,02 |
- 3,09 |
- 2,28 |
- 1,64 |
-1,18 |
Строим по опытным данным график ЕСd = f(lg aCd2+) .
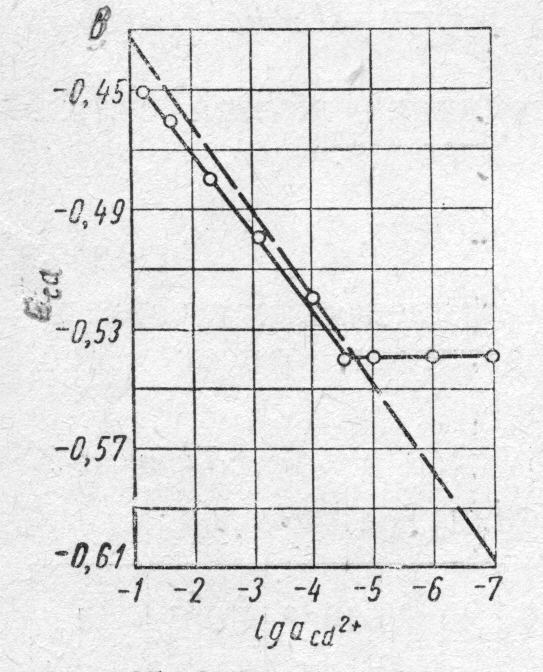
Рисунок 1 - Электродный потенциал кадмия в растворах СdCl2 как функция логарифма активности ионов кадмия: пунктирная линия – теоретическая за-висимость; сплошная линия – опытные данные
Определяем значения равновесного потенциала кадмия при активностях его ионов 10-7 и 10-1 по уравнению :
![]() ;
;
Е′ = - 0,609 В; Е˝ = - 0,432 В
и строим график теоретической зависимости ЕСd = f(lg aCd2+)
Как видно на рисунке 1 , опытная зависимость ЕСd = f(lg aCd2+) близка к теоретической в интервале lg a от – 1 до – 4,5, то есть потенциал кадмия близок к значениям обратимого потенциала в этом интервале активностей и совсем необратим в более разбавленных растворах, где вообще ЕСd ≠ f (lg aCd2+).
Пример 2. Найти равновесный потенциал водородного электрода в нейтральном 1М растворе NаCl при 25°С и рН2 = 1 атм.
Р е ш е н и е. В нейтральном растворе рН = 7. Согласно уравнению:
рН = - lg аН+ = 7
Подставляем это значение в уравнение потенциала водородного электрода, учитывая, что рН2 = 1 атм.
![]()
Пример 3. Определить равновесный потенциал водородного электрода: рН = 7; температура +5°С; давление 600 мм рт. ст.
Р е ш е н и е. Парциальное давление водорода в электроде в данных условиях
![]()
Искомый потенциал рассчитываем по уравнению :

Пример 4. Найти равновесный потенциал водородного электрода в 1М растворе NаОН при 25°С и рН2 = 1 атм.
Р е ш е н и е. Величина обратимого потенциала водородного электрода может быть найдена из уравнения :
![]()
Активность водородных ионов в растворе может быть найдена из уравнения:
![]()
следовательно,
![]()
Подставляем в это уравнение необходимые величины
![]()
![]()
Пример 5. Рассчитать равновесный потенциал водородного электрода в растворе 0,01М СН3СООН при 25°С.
Р е ш е н и е. Константа диссоциации СН3СООН при этой температуре К = 1,76·10-5. Для разбавленных растворов константу диссоциации электролита находят по уравнению
![]()
где
![]() - степень диссоциации электролита; с
– соответственно концентрация.
- степень диссоциации электролита; с
– соответственно концентрация.
Находим степень диссоциации СН3СООН при заданной концентрации:
1,76·10-5
=![]() ,
,
откуда α = 0,041.
Активность водородных ионов в растворе аН+= α·с = 0,041·0,01 = 0,00041.
Равновесный потенциал водородного электрода рассчитываем по уравнению:
![]()
Пример 6. Рассчитать равновесный потенциал кислородного электрода в нейтральном растворе 1 М Na2SO4 при 25°С в атмосфере воздуха.
Р е ш е н и е. Величина обратимого потенциала кислородного электрода может быть найдена из уравнения:

Воздух содержит по объему около 21% кислорода. Следовательно, парциальное давление кислорода в воздухе рО2 = 0,21 атм.
Активность гидроксид ионов в нейтральном растворе
![]()
так как рН = 7.
Определяем искомый потенциал:
![]()
Пример
7.
Найти равновесный потенциал кислородного
электрода в растворе 1
М
Н2SO4
при 25°С и p![]() = 1 атм.
= 1 атм.
Р е ш е н и е. Для определения величины равновесного потенциала кислородного электрода воспользуемся уравнением ; коэффициент активности ионов водорода равен 0,132.
![]()
Пример 8. Рассчитать равновесный потенциал кислородного электрода в растворе 1М NН4OH при 25°С, если эквивалентная электропроводность данного раствора при этой температуре λ=9,6 Ом-1·см2/г·экв.
Р
е ш е н и е. Эквивалентная электропроводность
NН4OH
при бесконечном разбавлении
![]()
Находим степень диссоциации NН4OH:
![]()
Активность гидроксид ионов в растворе:
![]()
Обратимый потенциал кислородного электрода рассчитываем по формуле:
![]()
Пример 9. Определить равновесный потенциал катодной реакции
S2O82-
+ 2e
Û2SO42-
при 20°C
в растворе, в котором а![]() = 1 и a
= 1 и a![]() = 0,01.
= 0,01.
Р е ш е н и е. Стандартный окислительно – восстановительный потенциал реакции Ео = 2,05В. Определяем потенциал по уравнению:
![]()
где p и q – стехиометрические коэффициенты окислителя и соответственно восстановителя в окислительно - восстановительной реакции.
