
- •Предисловие
- •Введение
- •Литература
- •Тема: основы химической термодинамики, термохимии. Определение теплоты растворения вещества
- •Учебно-целевые вопросы
- •Краткая теоретическая часть Основные понятия, определения, законы
- •Классификация термодинамических систем
- •I закон термодинамики
- •Стандартные условия (с.У.):
- •Э нтальпия реакции равна разности алгебраической суммы энтальпий сгорания исходных веществ и суммы энтальпий сгорания продуктов реакции с учетом их стехиометрических коэффициентов.
- •Нормальные величины суточной потребности в энергии для городского населения в зависимости от рода деятельности (данные Института питания амн ссср)
- •II закон термодинамики
- •Математическая форма второго начала термодинамики для изолированных систем:
- •Изменение знака g при изменении знаков н и s
- •В заимосвязь термодинамических величин
- •Особенности термодинамики биохимических процессов
- •Принцип энергетического сопряжения биохимических реакций
- •Многостадийность, обратимость
- •Гомеостаз
- •Обучающие тесты с решением
- •Обучающие задачи с решением
- •Учебно-исследовательская лабораторная работа « Определение теплового эффекта процесса растворения безводной соли»
- •Контрольные вопросы для защиты экспериментальной работы
- •Учебно-исследовательская лабораторная работа «Определение энтальпии нейтрализации»
- •Контрольные вопросы для защиты экспериментальной работы.
- •Краткая теоретическая часть Основные понятия, определения, формулы
- •Природа реагирующих веществ
- •Концентрация реагентов
- •Давление
- •Влияние величины поверхности соприкосновения реагирующих веществ
- •Влияние катализатора
- •Общие принципы катализа
- •Механизм действия катализатора
- •Суть механизма гомогенного катализа
- •Особенности механизма гетерогенного катализа
- •Ферментативный катализ
- •Особенности ферментативного катализа
- •Обучающие тесты с решением
- •Обучающие задачи с решением
- •« Химическая кинетика. Катализ»
- •Контрольные вопросы для защиты экспериментальной работы
- •Тема: химическое равновесие
- •Учебно-целевые вопросы
- •Краткая теоретическая часть
- •Смещение химического равновесия
- •Способы смещения равновесия
- •Обучающие тесты с решением
- •Обучающие задачи с решением
- •« Химическое равновесие»
- •Контрольные вопросы для защиты экспериментальной работы
- •Задачи для самостоятельного решения
- •Тематика рефератов
- •Приложение
- •Основные термодинамические и кинетические величины
- •Термодинамические свойства некоторых веществ, применяемых в медицине
- •3. Теплоты сгорания (н , кДж/моль) некоторых веществ
- •4. Средняя удельная теплота полного окисления основных компонентов пищевых продуктов
- •5. Периоды полураспада некоторых радионуклидов, применяемых в медицине
- •Калорийность продуктов питания
- •Содержание
II закон термодинамики
II закон термодинамики определяет условия самопроизвольного протекания процессов. Установлено, что все самопроизвольные процессы реализуются под влиянием двух основных факторов:
1) стремления системы к достижению минимума энергии;
2) стремления системы к увеличению ее энтропии, т.е. возрастанию беспорядка в ней.
Э нтропия (S) – термодинамическая функция, характеризующая меру неупорядоченности движения частиц системы, т.е. неоднородности расположения и перемещения ее частиц.
Для обратимого процесса:
S
=
![]() ;
;
Для необратимого процесса:
S
![]()
где S – изменение энтропии системы;
Q – теплота, передаваемая системе;
Т абсолютная температура, при которой осуществляется процесс.
Энтропия – экстенсивное свойство системы: S = Sкон Sнач
Изменение энтропии как функции состояния можно рассчитать, используя следствие из закона Гесса:
Sор-ции
=
![]() Sо(прод.
р-ции)
Sо(исх.
в-в),
Sо(прод.
р-ции)
Sо(исх.
в-в),
где Sо – стандартная энтропия образования вещества.
Значения стандартных энтропий образования некоторых веществ приведены в табл. 2 приложения.
Величина энтропии зависит: от агрегатного состояния, аллотропной формы, температуры, давления, сложности системы.
Энтропия вещества в газообразном состоянии больше, чем энтропия его в жидком состоянии, а последняя больше энтропии этого вещества в твердом состоянии: Sг > Sж > Sтв.
Энтропия простых веществ зависит от их аллотропной формы:
S(графит) > S(алмаз); S(O2) < S(O3)
Энтропия системы при повышении температуры возрастает, так как увеличивается неупорядоченность движения частиц:
если T1 > Т2, то S1 > S2
Энтропия системы при повышении давления уменьшается, так как снижается неупорядоченность движения частиц:
если р1 > р2, то S1 < S2
С увеличением сложности системы энтропия повышается, так как возрастает число видов частиц и вариантов их расположения.
Энтропия – важнейший термодинамический параметр, который является не только мерой неупорядоченности расположения и движения частиц в системе, но и мерой связанной энергии, которую система не может превратить в работу, критерием направления протекания самопроизвольного процесса, критерием глубины протекания процесса (S = Smax).
Свойства энтропии позволяют проследить цепочку усложняющихся образований от атомов элементов до белковых молекул, от неживой природы до живой клетки (рис. 2).
Существует несколько формулировок II закона термодинамики:
Т еплота
не может самопроизвольно переходить
от менее нагретого тела к более нагретому
(Р. Клаузиус, 1850 г.).
еплота
не может самопроизвольно переходить
от менее нагретого тела к более нагретому
(Р. Клаузиус, 1850 г.).
Н евозможно построить вечный двигатель второго рода, т.е. невозможно теплоту полностью превратить в работу (В. Томсон)
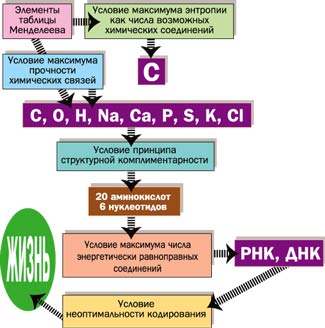
Рис 2. Схема образования от атомов элементов до белковых молекул, от неживой природы до живой клетки
В се
самопроизвольные процессы в макроскопических
системах протекают в направлении от
менее вероятного состояния к более
вероятному состоянию системы (Л. Больцман)
се
самопроизвольные процессы в макроскопических
системах протекают в направлении от
менее вероятного состояния к более
вероятному состоянию системы (Л. Больцман)
В изолированных системах самопроизвольно
могут совершаться только такие процессы,
в которых энтропия системы возрастает:
S
0.
изолированных системах самопроизвольно
могут совершаться только такие процессы,
в которых энтропия системы возрастает:
S
0.
В любой изолированной системе полная
энергия остается постоянной, а полная
энтропия со временем только повышается:
U
= 0, S
0.
любой изолированной системе полная
энергия остается постоянной, а полная
энтропия со временем только повышается:
U
= 0, S
0.
