
- •Предисловие
- •Введение
- •Литература
- •Тема: основы химической термодинамики, термохимии. Определение теплоты растворения вещества
- •Учебно-целевые вопросы
- •Краткая теоретическая часть Основные понятия, определения, законы
- •Классификация термодинамических систем
- •I закон термодинамики
- •Стандартные условия (с.У.):
- •Э нтальпия реакции равна разности алгебраической суммы энтальпий сгорания исходных веществ и суммы энтальпий сгорания продуктов реакции с учетом их стехиометрических коэффициентов.
- •Нормальные величины суточной потребности в энергии для городского населения в зависимости от рода деятельности (данные Института питания амн ссср)
- •II закон термодинамики
- •Математическая форма второго начала термодинамики для изолированных систем:
- •Изменение знака g при изменении знаков н и s
- •В заимосвязь термодинамических величин
- •Особенности термодинамики биохимических процессов
- •Принцип энергетического сопряжения биохимических реакций
- •Многостадийность, обратимость
- •Гомеостаз
- •Обучающие тесты с решением
- •Обучающие задачи с решением
- •Учебно-исследовательская лабораторная работа « Определение теплового эффекта процесса растворения безводной соли»
- •Контрольные вопросы для защиты экспериментальной работы
- •Учебно-исследовательская лабораторная работа «Определение энтальпии нейтрализации»
- •Контрольные вопросы для защиты экспериментальной работы.
- •Краткая теоретическая часть Основные понятия, определения, формулы
- •Природа реагирующих веществ
- •Концентрация реагентов
- •Давление
- •Влияние величины поверхности соприкосновения реагирующих веществ
- •Влияние катализатора
- •Общие принципы катализа
- •Механизм действия катализатора
- •Суть механизма гомогенного катализа
- •Особенности механизма гетерогенного катализа
- •Ферментативный катализ
- •Особенности ферментативного катализа
- •Обучающие тесты с решением
- •Обучающие задачи с решением
- •« Химическая кинетика. Катализ»
- •Контрольные вопросы для защиты экспериментальной работы
- •Тема: химическое равновесие
- •Учебно-целевые вопросы
- •Краткая теоретическая часть
- •Смещение химического равновесия
- •Способы смещения равновесия
- •Обучающие тесты с решением
- •Обучающие задачи с решением
- •« Химическое равновесие»
- •Контрольные вопросы для защиты экспериментальной работы
- •Задачи для самостоятельного решения
- •Тематика рефератов
- •Приложение
- •Основные термодинамические и кинетические величины
- •Термодинамические свойства некоторых веществ, применяемых в медицине
- •3. Теплоты сгорания (н , кДж/моль) некоторых веществ
- •4. Средняя удельная теплота полного окисления основных компонентов пищевых продуктов
- •5. Периоды полураспада некоторых радионуклидов, применяемых в медицине
- •Калорийность продуктов питания
- •Содержание
Влияние величины поверхности соприкосновения реагирующих веществ
Для гетерогенных систем (когда вещества находятся в разных агрегатных состояниях), чем больше поверхность соприкосновения, тем быстрее протекает реакция. Поверхность твердых веществ может быть увеличена путем их измельчения, а для растворимых веществ – путем их растворения.
Влияние катализатора
Катализ – явление изменения скорости химической реакции веществами, которые участвуют в реакции, но не входят в состав конечных продуктов.
Р азличают
следующие виды катализа:
азличают
следующие виды катализа:
Обычно термин «катализ» относят к положительному катализу.
Примером отрицательного катализа может быть ингибирование ферментов при взаимодействии с катионами элементов-токсикантов: Hg2+, Pb2+, Cd2+, As3+.
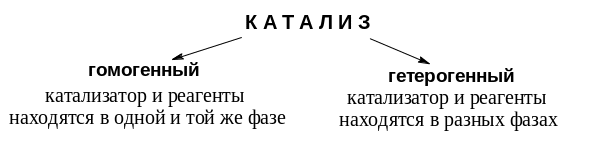
Примером гомогенного катализа является реакция разложения пероксида водорода в присутствии солей железа(II) в водных растворах:
2H2O2 ;;(((;Fe2+ 2H2O + O2
Примером гетерогенного катализа является синтез аммиака из водорода и азота в присутствии металлического железа:
3H2 + N2 (;;(;Fe 2NH3
Разновидностью гомогенного катализа является кислотно-основной катализ.
К таким реакциям относится омыление сложных эфиров и амидов:
CH3COOC2H5 ((;; ((;Н+ CH3COOH + C2H5OH
К атализаторы
– молекулы, ионы, атомы, поверхности,
участвующие в реакции, изменяющие
скорость термодинамически возможных
реакций за счет уменьшения или увеличения
энергии активации, но остающиеся
химически неизменными в результате
реакции.
атализаторы
– молекулы, ионы, атомы, поверхности,
участвующие в реакции, изменяющие
скорость термодинамически возможных
реакций за счет уменьшения или увеличения
энергии активации, но остающиеся
химически неизменными в результате
реакции.

Для оценки влияния катализатора на скорость реакции можно использовать уравнение Аррениуса в следующем виде:
![]()
Общие принципы катализа
Катализаторы ускоряют только термодинамически возможные реакции.
Катализаторы ускоряют химическую реакцию, как правило, за счет снижения энергии активации реакции, образуя промежуточные соединения.
Катализаторы увеличивают скорости как прямой, так и обратной реакций, ускоряя достижение химического равновесия.
Катализаторы после завершения реакции остаются в неизменном виде и количестве.
Все каталитические реакции сложные, так как состоят, как минимум, из двух элементарных актов:
а) Реагент + катализатор промежуточное соединение;
б) Промежуточное соединение продукты реакции + катализатор.
Действие катализатора можно изменить: промоторы – усиливают, а каталитические яды – блокируют действие катализатора.
Промотирование – увеличение активности катализатора в присутствии веществ, которые сами не являются катализаторами данного процесса (промоторов).
Например, для катализируемой металлическим никелем реакции:
СО + Н2 СН4 + Н2О
введение в никелевый катализатор небольшой примеси церия приводит к резкому возрастанию активности катализатора.
Отравление – резкое снижение активности катализатора в присутствии некоторых веществ (т. н. каталитических ядов).
Например, для реакции синтеза аммиака (катализатор – губчатое железо), присутствие в реакционной смеси соединений кислорода или серы вызывает резкое снижение активности железного катализатора; в то же время способность катализатора адсорбировать исходные вещества снижается очень незначительно.
Действие некоторых лекарственных препаратов основано на промотировании или отравлении ферментов.
