
- •Предисловие
- •Введение
- •Литература
- •Тема: основы химической термодинамики, термохимии. Определение теплоты растворения вещества
- •Учебно-целевые вопросы
- •Краткая теоретическая часть Основные понятия, определения, законы
- •Классификация термодинамических систем
- •I закон термодинамики
- •Стандартные условия (с.У.):
- •Э нтальпия реакции равна разности алгебраической суммы энтальпий сгорания исходных веществ и суммы энтальпий сгорания продуктов реакции с учетом их стехиометрических коэффициентов.
- •Нормальные величины суточной потребности в энергии для городского населения в зависимости от рода деятельности (данные Института питания амн ссср)
- •II закон термодинамики
- •Математическая форма второго начала термодинамики для изолированных систем:
- •Изменение знака g при изменении знаков н и s
- •В заимосвязь термодинамических величин
- •Особенности термодинамики биохимических процессов
- •Принцип энергетического сопряжения биохимических реакций
- •Многостадийность, обратимость
- •Гомеостаз
- •Обучающие тесты с решением
- •Обучающие задачи с решением
- •Учебно-исследовательская лабораторная работа « Определение теплового эффекта процесса растворения безводной соли»
- •Контрольные вопросы для защиты экспериментальной работы
- •Учебно-исследовательская лабораторная работа «Определение энтальпии нейтрализации»
- •Контрольные вопросы для защиты экспериментальной работы.
- •Краткая теоретическая часть Основные понятия, определения, формулы
- •Природа реагирующих веществ
- •Концентрация реагентов
- •Давление
- •Влияние величины поверхности соприкосновения реагирующих веществ
- •Влияние катализатора
- •Общие принципы катализа
- •Механизм действия катализатора
- •Суть механизма гомогенного катализа
- •Особенности механизма гетерогенного катализа
- •Ферментативный катализ
- •Особенности ферментативного катализа
- •Обучающие тесты с решением
- •Обучающие задачи с решением
- •« Химическая кинетика. Катализ»
- •Контрольные вопросы для защиты экспериментальной работы
- •Тема: химическое равновесие
- •Учебно-целевые вопросы
- •Краткая теоретическая часть
- •Смещение химического равновесия
- •Способы смещения равновесия
- •Обучающие тесты с решением
- •Обучающие задачи с решением
- •« Химическое равновесие»
- •Контрольные вопросы для защиты экспериментальной работы
- •Задачи для самостоятельного решения
- •Тематика рефератов
- •Приложение
- •Основные термодинамические и кинетические величины
- •Термодинамические свойства некоторых веществ, применяемых в медицине
- •3. Теплоты сгорания (н , кДж/моль) некоторых веществ
- •4. Средняя удельная теплота полного окисления основных компонентов пищевых продуктов
- •5. Периоды полураспада некоторых радионуклидов, применяемых в медицине
- •Калорийность продуктов питания
- •Содержание
Классификация термодинамических систем
В зависимости от однородности различают
системы
гомогенные и гетерогенные.
зависимости от однородности различают
системы
гомогенные и гетерогенные.
В зависимости от характера взаимодействия
с окружающей средой различают системы
изолированные,
закрытые и открытые.
зависимости от характера взаимодействия
с окружающей средой различают системы
изолированные,
закрытые и открытые.
В термодинамике различают три состояния системы: равновесное, стационарное и переходное.
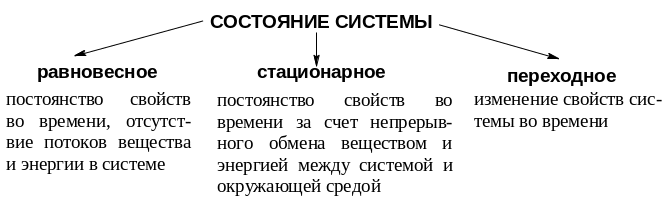
Д![]() ля
живого организма характерно стационарное
состояние.
ля
живого организма характерно стационарное
состояние.
Состояние системы характеризуется параметрами.
П араметры
системы
– совокупность физических и химических
величин, характеризующих состояние
системы.
араметры
системы
– совокупность физических и химических
величин, характеризующих состояние
системы.
П араметры
системы подразделяют на экстенсивные
и интенсивные.
араметры
системы подразделяют на экстенсивные
и интенсивные.
При взаимодействии систем значения экстенсивных параметров суммируются, а интенсивных – усредняются.
Например, при смешивании горячего кофе и холодного молока, объемы суммируются, а температура усредняется.
Наряду с параметрами для характеристики состояния системы используют функции состояния.
Функции состояния – экстенсивные величины, которые нельзя непосредственно измерить экспериментально, характеризующие состояние системы. Их значения зависят только от данного состояния системы и не зависят от того, каким путем это состояние достигнуто. К функциям состояния относятся: внутренняя энергия (U), энтальпия (Н), энтропия (S), свободная энергия Гиббса (G).
Переход системы из одного состояния в другое является процессом.

Процесс – переход системы из одного состояния в другое, сопровождающийся необратимым или обратимым изменением хотя бы одного параметра, характеризующего данную систему.


Неотъемлемое свойство материи – движение. Оно проявляется в разных формах качественно отличающихся друг от друга, но взаимосвязанных между собой и превращающихся друг в друга. Мерой движения является энергия.
Э нергия
– это количественная мера различных
форм движения и взаимодействия всех
видов материи. Энергия является
неотъемлемым свойством системы.
нергия
– это количественная мера различных
форм движения и взаимодействия всех
видов материи. Энергия является
неотъемлемым свойством системы.

Рис. 1. Виды энергии химической системы
В зависимости от форм движения материи различают следующие виды энергии: тепловая, электрическая, химическая, ядерная и т.д. Термодинамика рассматривает процессы взаимного перехода тепловой энергии в другие виды (механическую, химическую, электрическую и т.д.).
В химической термодинамике важное значение имеет понятие внутренней энергии системы.
В нутренняя энергия (U) системы – это сумма потенциальной энергии взаимодействия всех частиц системы между собой и кинетической энергии их движения.
Внутренняя энергия системы складывается из поступательного и вращательного движения молекул, энергии внутримолекулярного колебательного движения атомов и атомных групп, составляющих молекулы, энергии вращения электронов в атомах, энергии, заключающейся в ядрах атомов, энергии межмолекулярного взаимодействия и других видов энергии.
![]() ,
кДж/моль
,
кДж/моль
Внутренняя энергия – функция состояния, абсолютное значение которой определить невозможно, так как любая термодинамическая система материальна, а материя – неисчерпаема. Экспериментально можно определить только изменение внутренней энергии в процессе взаимодействия системы с окружающей средой. Поскольку внутренняя энергия является функцией состояния, то величина U зависит от начального и конечного состояния системы, но не зависит от способа или пути, которыми данная система приведена из начального в конечное состояние.
Обмен внутренней энергией между системой и окружающей средой может осуществляться в форме теплоты или работы.
Р абота (А или W) – энергетическая мера направленных форм движения частиц в процессе взаимодействия системы с окружающей средой.
Работа А считается положительной, если совершается системой против внешних сил окружающей среды.
Т еплота (Q)– энергетическая мера хаотических форм движения частиц в процессе взаимодействия системы с окружающей средой.
В термодинамике количество теплоты Q считается положительным, если теплота сообщается системе из окружающей среды.
Работа и теплота не являются функциями состояния, а являются функциями процесса, их величина зависит от пути процесса, по которому система перешла из одного состояния в другое.
