
- •Предисловие
- •Введение
- •Литература
- •Тема: основы химической термодинамики, термохимии. Определение теплоты растворения вещества
- •Учебно-целевые вопросы
- •Краткая теоретическая часть Основные понятия, определения, законы
- •Классификация термодинамических систем
- •I закон термодинамики
- •Стандартные условия (с.У.):
- •Э нтальпия реакции равна разности алгебраической суммы энтальпий сгорания исходных веществ и суммы энтальпий сгорания продуктов реакции с учетом их стехиометрических коэффициентов.
- •Нормальные величины суточной потребности в энергии для городского населения в зависимости от рода деятельности (данные Института питания амн ссср)
- •II закон термодинамики
- •Математическая форма второго начала термодинамики для изолированных систем:
- •Изменение знака g при изменении знаков н и s
- •В заимосвязь термодинамических величин
- •Особенности термодинамики биохимических процессов
- •Принцип энергетического сопряжения биохимических реакций
- •Многостадийность, обратимость
- •Гомеостаз
- •Обучающие тесты с решением
- •Обучающие задачи с решением
- •Учебно-исследовательская лабораторная работа « Определение теплового эффекта процесса растворения безводной соли»
- •Контрольные вопросы для защиты экспериментальной работы
- •Учебно-исследовательская лабораторная работа «Определение энтальпии нейтрализации»
- •Контрольные вопросы для защиты экспериментальной работы.
- •Краткая теоретическая часть Основные понятия, определения, формулы
- •Природа реагирующих веществ
- •Концентрация реагентов
- •Давление
- •Влияние величины поверхности соприкосновения реагирующих веществ
- •Влияние катализатора
- •Общие принципы катализа
- •Механизм действия катализатора
- •Суть механизма гомогенного катализа
- •Особенности механизма гетерогенного катализа
- •Ферментативный катализ
- •Особенности ферментативного катализа
- •Обучающие тесты с решением
- •Обучающие задачи с решением
- •« Химическая кинетика. Катализ»
- •Контрольные вопросы для защиты экспериментальной работы
- •Тема: химическое равновесие
- •Учебно-целевые вопросы
- •Краткая теоретическая часть
- •Смещение химического равновесия
- •Способы смещения равновесия
- •Обучающие тесты с решением
- •Обучающие задачи с решением
- •« Химическое равновесие»
- •Контрольные вопросы для защиты экспериментальной работы
- •Задачи для самостоятельного решения
- •Тематика рефератов
- •Приложение
- •Основные термодинамические и кинетические величины
- •Термодинамические свойства некоторых веществ, применяемых в медицине
- •3. Теплоты сгорания (н , кДж/моль) некоторых веществ
- •4. Средняя удельная теплота полного окисления основных компонентов пищевых продуктов
- •5. Периоды полураспада некоторых радионуклидов, применяемых в медицине
- •Калорийность продуктов питания
- •Содержание
Учебно-исследовательская лабораторная работа « Определение теплового эффекта процесса растворения безводной соли»
Цели работы:
Научиться экспериментально определять энтальпию растворения безводной соли с использованием калориметра.
Научиться теоретически рассчитывать энтальпию растворения вещества, используя закон Гесса.
Оборудование: 1. Калориметр. 2. Термометр. 3. Цилиндр мерный.
Реактивы: навеска безводной соли карбоната натрия.
Порядок выполнения работы:
Опыт проводится в упрощенном калориметре (рис. 4).

Рис. 4. Схема калориметра
Воздушная прослойка между двумя сосудами калориметра обеспечивает теплоизоляцию внутреннего сосуда, в котором происходит растворение вещества.
Отмерьте 50,0 мл дистиллированной воды с помощью цилиндра и перенесите во внутренний сосуд калориметра. Опустите в воду термометр и записывайте показания термометра с точностью до 0,1оС через 30 с в течение 5 мин.
Не прекращая измерять температуру, аккуратно высыпьте в сосуд с водой 2 г карбоната натрия.
Осторожно перемешивая раствор, записывайте показания термометра с точностью 0,1оС через каждые 30 с. Продолжительность этого периода зависит от скорости реакции и скорости перемешивания. Поскольку изучаемый процесс является экзотермическим, то температура быстро повышается, а затем постепенно вновь устанавливается равномерный ход температуры.
После перехода к равномерному изменению температуры продолжайте отсчет температуры еще 5 мин с интервалом 30 сек.
По окончании работы вылейте содержимое калориметра и промойте калориметр дистиллированной водой
По полученным данным постройте график зависимости температура – время.
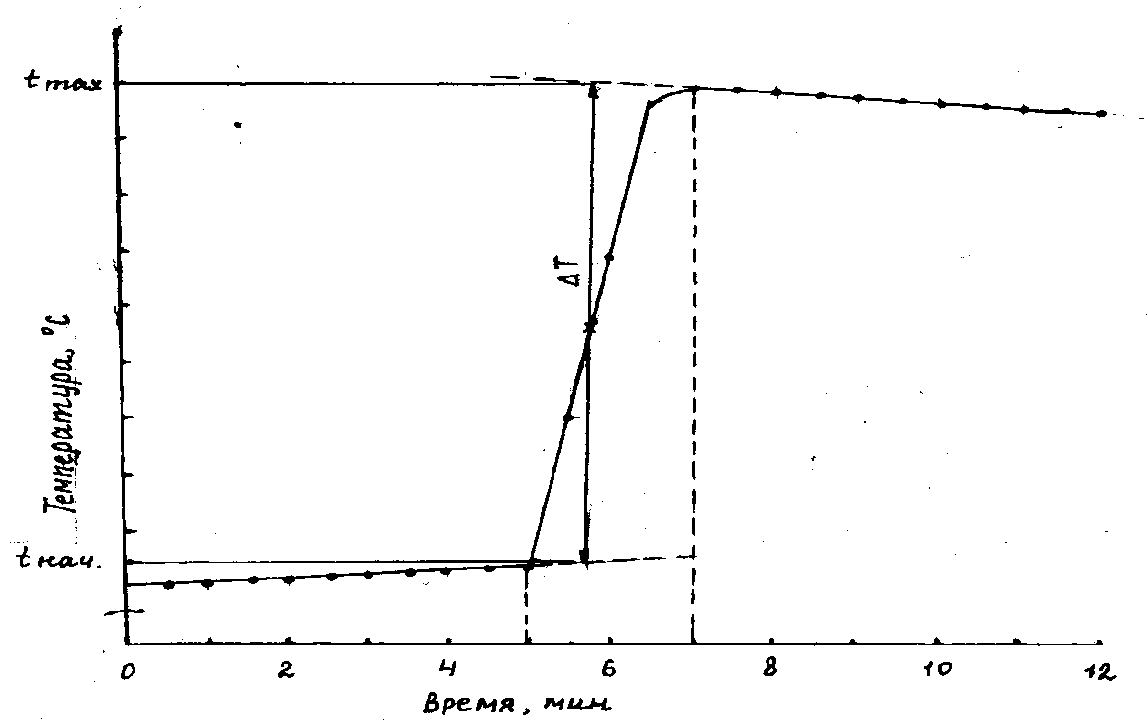
Рис. 5. График зависимости температуры растворения веществ от времени
По графику определите наивысшую температуру раствора (tmax) и рассчитайте разность температур t = tmax – tнач.
Зная общую массу раствора, равную сумме массы соли и массы воды, приняв удельную теплоемкость раствора (
 )
равной 4,18, определите экспериментальную
энтальпию растворения безводного
карбоната натрия в пересчете на 1 моль
безводной соли:
)
равной 4,18, определите экспериментальную
энтальпию растворения безводного
карбоната натрия в пересчете на 1 моль
безводной соли:
 ,
кДж/моль
,
кДж/мольРассчитайте по закону Гесса теоретическую энтальпию растворения безводного карбоната натрия и сравните ее с энтальпией, найденной опытным путем. Учтите, что при растворении безводной соли происходит ее гидратация, а затем растворение кристаллогидрата (кр/г) в воде.
П роцессы
гидратации Na2CO3
и растворения получающегося кристаллогидрата
могут быть выражены следующими
термохимическими уравнениями:
роцессы
гидратации Na2CO3
и растворения получающегося кристаллогидрата
могут быть выражены следующими
термохимическими уравнениями:
Na2CO3 + 10H2O = Na2CO310H2O; Нгидр = 91,21 кДж
Na2CO310H2O + aq = Na2CO3aq; Нраств-я кр/г = 67,61 кДж
Поэтому теоретическая энтальпия растворения равна алгебраической сумме энтальпии гидратации безводной соли и энтальпии растворения гидратированной соли:
Нраств. = Нгидр.+ Нраств-я кр/г
Рассчитайте абсолютную и относительную ошибки определения энтальпии растворения Na2CO3:
dабс.
= Нэксп.
Нтеор.;
![]()
Сделайте вывод к проделанной работе.
План оформления отчета:
Дата и название работы.
Цель работы.
Краткое описание проведения опыта.
Результаты полученных опытных данных.
Выводы по работе.
