- •Предисловие
- •Введение
- •Литература
- •Тема: основы химической термодинамики, термохимии. Определение теплоты растворения вещества
- •Учебно-целевые вопросы
- •Краткая теоретическая часть Основные понятия, определения, законы
- •Классификация термодинамических систем
- •I закон термодинамики
- •Стандартные условия (с.У.):
- •Э нтальпия реакции равна разности алгебраической суммы энтальпий сгорания исходных веществ и суммы энтальпий сгорания продуктов реакции с учетом их стехиометрических коэффициентов.
- •Нормальные величины суточной потребности в энергии для городского населения в зависимости от рода деятельности (данные Института питания амн ссср)
- •II закон термодинамики
- •Математическая форма второго начала термодинамики для изолированных систем:
- •Изменение знака g при изменении знаков н и s
- •В заимосвязь термодинамических величин
- •Особенности термодинамики биохимических процессов
- •Принцип энергетического сопряжения биохимических реакций
- •Многостадийность, обратимость
- •Гомеостаз
- •Обучающие тесты с решением
- •Обучающие задачи с решением
- •Учебно-исследовательская лабораторная работа « Определение теплового эффекта процесса растворения безводной соли»
- •Контрольные вопросы для защиты экспериментальной работы
- •Учебно-исследовательская лабораторная работа «Определение энтальпии нейтрализации»
- •Контрольные вопросы для защиты экспериментальной работы.
- •Краткая теоретическая часть Основные понятия, определения, формулы
- •Природа реагирующих веществ
- •Концентрация реагентов
- •Давление
- •Влияние величины поверхности соприкосновения реагирующих веществ
- •Влияние катализатора
- •Общие принципы катализа
- •Механизм действия катализатора
- •Суть механизма гомогенного катализа
- •Особенности механизма гетерогенного катализа
- •Ферментативный катализ
- •Особенности ферментативного катализа
- •Обучающие тесты с решением
- •Обучающие задачи с решением
- •« Химическая кинетика. Катализ»
- •Контрольные вопросы для защиты экспериментальной работы
- •Тема: химическое равновесие
- •Учебно-целевые вопросы
- •Краткая теоретическая часть
- •Смещение химического равновесия
- •Способы смещения равновесия
- •Обучающие тесты с решением
- •Обучающие задачи с решением
- •« Химическое равновесие»
- •Контрольные вопросы для защиты экспериментальной работы
- •Задачи для самостоятельного решения
- •Тематика рефератов
- •Приложение
- •Основные термодинамические и кинетические величины
- •Термодинамические свойства некоторых веществ, применяемых в медицине
- •3. Теплоты сгорания (н , кДж/моль) некоторых веществ
- •4. Средняя удельная теплота полного окисления основных компонентов пищевых продуктов
- •5. Периоды полураспада некоторых радионуклидов, применяемых в медицине
- •Калорийность продуктов питания
- •Содержание
Принцип энергетического сопряжения биохимических реакций
В живых системах эндэргонические реакции (Gр-ции 0) сопряжены с экзэргоническими (Gр-ции 0). Для сопряжения энд- и экзэргонических процессов необходимо наличие общего промежуточного соединения и чтобы на всех стадиях сопряженных реакций суммарный процесс характеризовался :
![]() 0.
0.
Пример энергетического сопряжения.
глюкоза + фруктозасахароза + Н2О;
 =+20,9
кДж/моль
=+20,9
кДж/моль
II.
АТФ
+ Н2О
АДФ + Ф;
![]() =
30,5
кДж/моль.
=
30,5
кДж/моль.
Эти две реакции I и II сопряжены за счет образования при совместном протекании общего промежуточного соединения глюкозо-1-фосфат - интермедиата.
Суммарный процесс:
АТФ + глюкоза + фруктоза сахароза + АДФ + Ф
![]() =
29,2
кДж/моль;
=
29,2
кДж/моль; ![]()
0.
0.
Обратите внимание! Связи, по которым гидролиз проходит с большой убылью энергии Гиббса, в биохимии принято называть макроэргическими. Этот термин нельзя трактовать как «богатую энергией связь». Для разрыва химической связи всегда требуется затрата энергии. Представление о том, что процесс расщепления связи поставляет энергию для химической работы, не имеет физического смысла. Необходимая для энергетического сопряжения энергия высвобождается в результате перегруппировки атомов в реагентах, среди которых имеется один с макроэргической связью.
Внутренним источником энергии в живых системах являются фосфорилированные соединения (АТФ, креатинфосфат и другие), при взаимодействии которых с биосубстратами, включая воду, выделяется энергия, необходимая для протекания важных для организма эндэргонических процессов.
Термодинамические особенности живых организмов объясняют его устойчивость, позволяющую много лет сохранять работоспособность на определенном уровне, а также относительное постоянство внутренней среды – гомеостаз.
Многостадийность, обратимость
Другая особенность биохимических процессов, протекающих в организме, заключается в их многостадийности, так как вероятность обратимого протекания отдельной стадии значительно выше, чем всего процесса в целом (рис. 2). Это объясняется тем, что разница между величинами Gнач и Gкон для каждой отдельной стадии обычно невелика (|Gр| 10 Дж/моль). Обратимость отдельных стадий биохимических процессов позволяет живому организму легко регулировать синтез тех или иных соединений в зависимости от потребности и тем самым поддерживать стационарное состояние. Вероятность прямой реакции тем больше, чем больше уменьшение энергии Гиббса.
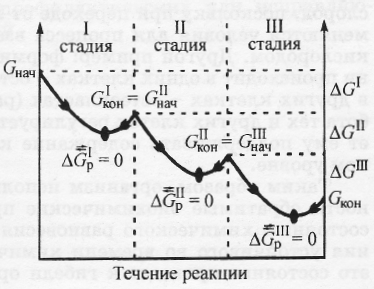
Рис. 3. Изменение энергии Гиббса в многостадийном биохимическом процессе (р, Т = const)
Гомеостаз
В живых организмах некоторые процессы и реакции протекают в условиях, близких к равновесным (например, протолитические, гетерогенные, лигандообменные, окислительно-восстано-вительные, адсорбционные). В связи с этим в организме поддерживаются различные балансы: кислотно-основной, гетерогенный, лигандообменный, окислительно-восстановительный, что в целом и определяет гомеостаз.
С амое замечательное свойство химических реакций, протекающих в живых клетках, которое в конечном итоге и делает возможным успешное функционирование клеток в качестве химических машин, состоит в том, что реакции катализируемые ферментами, протекают со 100%-ным выходом и не сопровождаются образованием побочных продуктов.