
- •Предисловие Модуль курса общей химии «Основы электрохимии. Редокс-процессы и равновесия» для студентов медицинского вуза включает следующие подразделы (модульные единицы):
- •Тема: Редокс-процессы (овр) и равновесия. Редокс-потенциалы, биологическая роль
- •Краткая теоретическая часть
- •Классификация овр
- •Составление уравнений овр
- •Направление овр
- •Редокс-процессы (овр) в живых организмах
- •Тема: Электрическая проводимость растворов электролитов. Кондуктометрия, ее применение в медико-биологических исследованиях
- •Краткая теоретическая часть. Основные понятия, определения, формулы
- •Электрическая проводимость. Удельная электрическая проводимость раствора.
- •Закон независимого движения ионов Кольрауша
- •Кондуктометрические методы анализа
- •Использование кондуктометрии в медицине
- •Электролиты в организме. Слюна как раствор электролитов
- •Учебно-исследовательская лабораторная работа № 1 «Определение степени и константы диссоциации уксусной кислоты кондуктометрическим методом»
- •Электродные потенциалы
- •Стандартный электродный потенциал
- •Классификация электродов
- •Поэтому водородный электрод можно использовать в качестве индикаторного для определения рН среды.
- •Активная концентрация восстановленной формы больше активной концентрации окисленной формы (рис. 12 а).
- •Активная концентрация восстановленной формы меньше активной концентрации окисленной формы (рис. 12 б).
- •Активные концентрации окисленной и восстановленной форм равны, но электронодонорная способность восстановленной формы не совпадает с электроноакцепторной способностью окисленной формы.
- •Гальванические элементы
- •Определение электродных потенциалов
- •Тема: Биопотенциалы (диффузионные, мембранные)
- •Краткая теоретическая часть Основные понятия, определения, формулы Диффузионный потенциал
- •Мембранный потенциал
- •Биоэлектрические потенциалы. Потенциалы покоя и действия
- •Тема: Потенциометрия, применение в физико-химических методах исследования
- •Краткая теоретическая часть Основные понятия, определения, формулы
- •Стеклянный водородный электрод
- •Электроды сравнения
- •Определение рН биологических жидкостей
- •Понятие о потенциометрическом титровании
- •Учебно-исследовательская лабораторная работа № 2 «Потенциометрическое определение рН биологических жидкостей»
- •Тема: Электрохимическая коррозия. Возникновение гальванопар при металлопротезировании. Коррозионная стойкость конструкционных стоматологических материалов
- •Краткая теоретическая часть
- •Учебно-исследовательская лабораторная работа № 3 «Образование микрогальванических элементов при контакте металлов»
- •Обучающие задачи с решением
- •Ответ: потенциал водородного электрода в исследуемом растворе равен –0,068 в.
- •Задачи для самостоятельного решения
- •Теоретические вопросы для студентов стоматологического факультета
- •Теоретические вопросы для студентов медико-профилактического факультета
- •Приложение
- •1.Основные величины, используемые в электрохимии
- •Значения предельных подвижностей ионов (uо, м2/(вс)) в водных растворах при 298 к.
- •3. Предельная молярная электрическая проводимость ионов (, Смм2моль–1)
- •Значения удельных электрических проводимостей
- •5. Стандартные восстановительные (редокс) потенциалы (25оС)
- •7. Потенциалы электродов сравнения
- •Литература
- •Оглавление
- •Окисление глюкозы
Гальванические элементы
F Гальванический
элемент –
это устройство, в котором химическая
энергия окислительно-восстановительной
реакции превращается в электрическую
энергию за счет пространственного
разделения процессов окисления и
восстановления.
Гальванический
элемент –
это устройство, в котором химическая
энергия окислительно-восстановительной
реакции превращается в электрическую
энергию за счет пространственного
разделения процессов окисления и
восстановления.
Гальванический элемент состоит из двух электродов, соединенных во внешней цепи металлическим проводником, а во внутренней цепи – электролитическим мостиком – стеклянной трубкой, заполненной насыщенным раствором КСl, или пористой перегородкой.
В гальваническом элементе различают анод и катод.
Анод – электрод, на котором протекает процесс окисления. Катионы металла переходят в раствор, масса анода уменьшается. Анод заряжается отрицательно. Пример анода:

Катод – электрод, на котором протекает процесс восстановления катионов металла из раствора, масса катода увеличивается. Катод заряжается положительно. Пример катода:
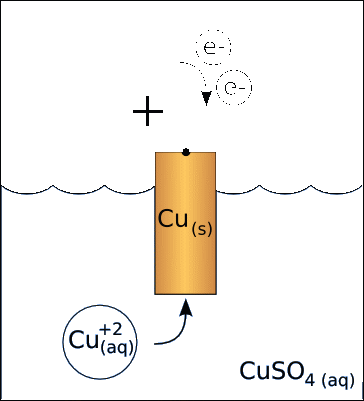
Условная запись гальванического элемента:
(–) Анод | Анодный раствор || Катодный раствор | Катод (+)
В схеме гальванического элемента согласно правилам ИЮПАК (Международный союз теоретической и прикладной химии) слева записывают анод, справа – катод.
Границу раздела между металлом и раствором обозначают одной вертикальной чертой. Границу раздела двух растворов – двумя сплошными вертикальными чертами, если диффузионный потенциал между ними полностью устранен, и пунктирной вертикальной чертой – если он остается. Компоненты одной фазы записывают через запятую.
Способность гальванического элемента к переносу электронов во внешней цепи характеризуется электродвижущей силой (ЭДС).
В обратимых условиях ЭДС гальванического элемента равна разности потенциалов катода и анода:
Е = (катода) – (анода).
Диффузионный потенциал должен быть при этом устранен.
ЭДС гальванического элемента зависит от:
природы электродов;
активности потенциалопределяющих ионов в анодном и катодном растворах;
температуры.
Наибольшее влияние на величину ЭДС оказывает природа электродов. Чем дальше друг от друга располагаются металлы в ряду напряжения, тем больше величина ЭДС.
Пример: Гальванический элемент Даниэля-Якоби.
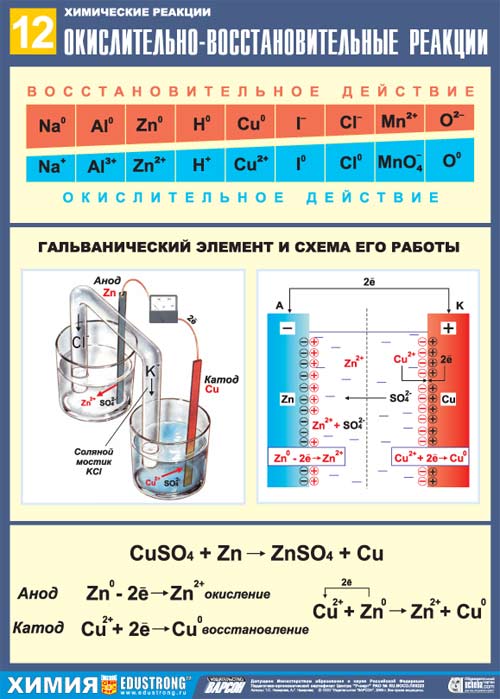
Этот элемент состоит из медной пластинки, погруженной в раствор сульфата меди и цинковой пластинки, погруженной в раствор сульфата цинка. Растворы соединены между собой солевым мостиком, заполненным хлоридом калия.
Схема элемента Даниэля-Якоби:
(–) Zn | ZnSO4 || CuSO4 | Cu (+)
Вместо соединений находящихся в растворах, можно указывать только потенциалопределяющие ионы. В этом случае схема гальванического элемента будет иметь вид:
Zn | Zn2+ || Cu2+ | Cu
При замыкании внешней и внутренней цепи в гальваническом элементе возникает электрический ток за счет протекания следующих процессов.
На аноде ионы цинка переходят в раствор, и масса цинковой пластинки уменьшается:
Zn = Zn2+ + 2ē
При замыкании полюсов элемента металлическим проводником электроны во внешней цепи будут переходить с цинковой пластинки на медную.
На катоде ионы меди осаждаются из раствора на медной пластинке, масса катода увеличивается:
Сu2+ + 2ē = Cu
Во внутренней цепи электрический ток переносится в основном ионами калия и хлора солевого мостика. Анионы хлора перемещаются в анодное пространство, катионы калия – в катодное пространство. В результате возникает замкнутая электрическая цепь.
Электрический ток обусловлен суммарной окислительно-восстановительной реакцией:
Zn + Cu2+ = Zn2+ + Cu
При обратимой работе гальванического элемента свободная энергия Гиббса ОВР, протекающей в гальваническом элементе, переходит в электрическую работу, которая определяется разностью потенциалов катода и анода:
G= –A = –nFE = –nF[(катода) – (анода)],
где: n – число электронов, принимающих участие в ОВР.
Для данного гальванического элемента:
G= –2F[(Cu2+/Cu) – (Zn2+/Zn)]
