
- •Ионометрическое определение нитратов
- •1 Этап. Кондиционирование нитрат-селективного электрода
- •2 Этап. Приготовление рабочих растворов нитрата калия
- •3 Этап. Построение градуировочного графика
- •4 Этап. Определение содержания нитратов в почве
- •5 Этап. Определение параметров селективности электрода
- •Ионометрическое определение фторид-ионов
- •1 Этап. Кондиционирование фторид-селективного электрода
- •2 Этап. Приготовление рабочих растворов фторида аммония
- •3 Этап. Построение градуировочного графика
- •4 Этап. Определение содержания фторидов в солях
- •5 Этап. Определение содержания фторидов в питьевой воде
- •6 Этап. Определение параметров селективности электрода
- •Ионометрическое определение калия
- •1 Этап. Кондиционирование калий-селективного электрода
- •2 Этап. Приготовление рабочих растворов хлорида калия
- •3 Этап. Построение градуировочного графика
- •4 Этап. Определение содержания калия в почве
- •5 Этап. Определение параметров селективности электрода
5 Этап. Определение параметров селективности электрода
Мешающее влияние посторонних ионов, присутствующих в анализируемом растворе, на величину потенциала электрода, без учета подвижностей определяемого и мешающего ионов, описывается уравнением Никольского.
![]()
где ai – активность основного иона,
aj – активность мешающего иона,
K![]() –
коэффициент селективности,
–
коэффициент селективности,
n – количество мешающих ионов, присутствующих в растворе.
Приведенное уравнения является полуэмпирическим и носит приближенный характер, т.к. не учитывает подвижности ионов, диффузионные процессы в приграничных слоях контактирующих фаз, однако это не снижает его достоинств – оно не содержит трудно определяемых параметров и в первом приближении хорошо описывает поведение электродов. Коэффициенты селективности K коррелируют с константами ионного обмена основного иона на мешающие.
Одним из основных мешающих ионов при определении нитратов в природных объектах, является хлорид ион. Потенциал нитрат-селективного электрода в присутствии хлорид-ионов можно рассчитать следующим образом:
![]()
где
![]() – коэффициент селективности хлорид-иона
на нитрат-ион в фазе мембраны.
– коэффициент селективности хлорид-иона
на нитрат-ион в фазе мембраны.
Одним из методов оценки селективности электродной системы является метод смешанных растворов. При этом, для исследования мешающего влияния хлорид-иона, в стаканчик помещают 10 мл раствора нитрата калия с концентрацией 2·10-4 моль/л и 10 мл раствора хлорида калия с концентрацией 2·10-1 моль/л, тщательно перемешивают и определяют величину потенциала Е1, которая описывается уравнением Никольского:
![]()
Затем в стаканчик помещают 20 мл раствора нитрата калия с концентрацией 2·10-4 моль/л и измеряют величину потенциала Е2:
![]()
Разность Е1 – Е2 приводит к соотношению:
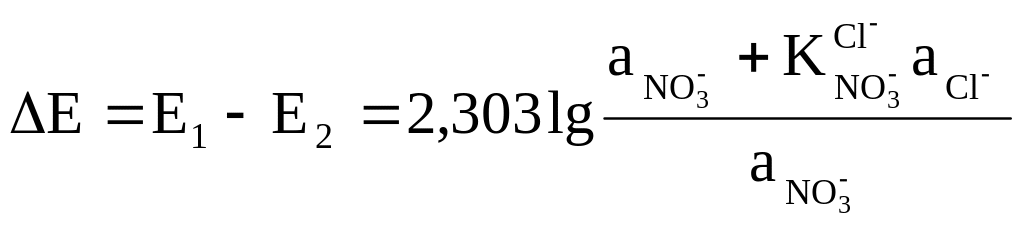 ,
,
из которого можно рассчитать численное значение коэффициента потенциометрической селективности .
Аналогичные измерения следует выполнить, используя раствор хлорида калия с концентрацией 2·10-2 моль/л, рассчитать величину коэффициента и взять среднее значение.
Полученную величину коэффициента сравнить с табличным значением.
Ионометрическое определение фторид-ионов
Фторид-селективный электрод – это ионоселективный электрод с твердофазной мембраной изготовленной из фторида лантана LaF3, легированного небольшим количеством европия (II).
Потенциал фторидного электрода подчиняется уравнению Нернста:
![]()
При зафиксированной ионной силе раствора уравнение Нернста может вместо активности фторид-ионов включать их равновесную концентрацию:
![]()
Как правило, уравнение Нернста выполняется в диапазоне концентраций фторид-иона от 10-1 до 10-5 моль/л. При меньших концентрациях наклон электродной функции изменяется и электрод теряет свою фторидную функцию.
Для электродов с кристаллическими мембранами предел обнаружения определяется в основном растворимостью кристалла LaF3 в воде. Величина растворимости фторида лантана рассчитывается из его произведения растворимости:
![]() =
=![]() =
=![]()
На практике такой предел обнаружения обычно не достигается, что объясняется протеканием обменных процессов на поверхности мембраны электрода, в результате которых происходит локальное увеличение концентрации фторид-ионов в приэлектродной области, которое и определяет величину реального предела обнаружения фторидного электрода.
Уникальная селективность фторидного электрода определяется строением кристаллической решетки фторида лантана, монокристалл которого имеет гексагональную решетку, состоящую из окруженных фторид-ионами слоев фторида лантана. При этом пять фторид-ионов находятся в непосредственной близости, а шесть фторид-ионов – в следующей координационной сфере. В такого рода решетках фторид-ионы отличаются высокой подвижностью, что и обуславливает высокую селективность фторидного электрода.
Селективность фторидного электрода настолько высока, что позволяет производить точное определение количественного содержания фторидов при более чем 1000-кратных избытках хлорид-, иодид-, нитрат-, фосфат-, бикарбонат- и других анионов.
Мешающее влияние на работу фторидного электрода будут оказывать катионы, способные связывать фторид-ионы в комплексные ионы или другие малодиссоциирующие соединения. К ним относятся катионы алюминия (III), железа (III), церия (III), а также катион водорода.
В кислых средах при рН<5 активность фторид-ионов резко уменьшается вследствие возможного протекания следующих реакций:
![]()
Среди мешающих определению фторид-ионов анионов следует выделить только ОН- - ионы, поскольку при высоких рН на поверхности электрода образуется слой гидроксида лантана по реакции обмена:
![]()
Растворимости фторида и гидроокиси лантана близки по величине, в результате чего в приэлектродный слой выделяется определенное количество фторид-ионов и потенциал электрода изменяется.
На практике, определение содержания фторидов в анализируемом растворе проводят в присутствии ацетатного буфера с рН = 5,5. Для точных измерений рекомендуется использовать специальный буферный раствор.
В
концентрированных растворах потенциал
фторидного электрода устанавливается
примерно за 30 секунд, в более разбавленных
растворах – за время до 3 минут.
Фторид-селективный электрод стабилен
в работе: дрейф потенциала электрода
составляет
![]() 2
мВ/неделю.
2
мВ/неделю.
ПРАКТИЧЕСКАЯ ЧАСТЬ
Поскольку ряд параметров в уравнении Нернста (Ео, наклон электродной функции) не являются строго постоянными и зависят от условий процесса измерений, определение активности фторид-ионов в анализируемых растворах обычно проводят с помощью предварительно построенного градуировочного графика.
Для
этого измеряют значения э.д.с. гальванической
ячейки, в состав которой входит
фторид-селективный электрод, в растворах
с известной активностью фторид-ионов
и строят зависимость
![]() .
.
Затем измеряют значение э.д.с. в исследуемом растворе и по градуировочному графику находят величину логарифма активности фторид-ионов.


