- •Прохождение тока в электрохимических системах. Законы фарадея
- •Лабораторная работа №2 электровесовой метод анализа
- •Лабораторная работа №3 кулонометрический метод анализа
- •2. Электрическая проводимость растворов электролитов
- •2.1. Методы измерения электрической проводимости
- •Лабораторная работа №4 измерение проводимости растворов электролитов различной концентрации
- •Лабораторная работа №5 определение температурного коэффициента электропроводности электролитов
- •Лабораторная работа № 6 определение растворимости и произведения растворимости труднорастворимой соли
- •Лабораторная работа № 7 определение константы дисоциации слабого электролита
- •Лабораторная работа № 8
- •3. Числа переноса ионов и методы их определения
- •Лабораторная работа №9 определение чисел переноса методом гитторфа
- •5. Электрохимические системы в равновесном состояни
- •Лабораторная работа № 10
- •Лабораторная работа № 11 измерение температурного коэффициента эдс гальванического элемента и расчет термодиинамических величин
- •1. Общие положения
- •2. Порядок выполнения работы
- •Лабораторная работа №12 определение константы нестойкости комплексных ионов меди
- •Лабораторная работа №13 определение стандартной эдс цепи без переноса
- •Лабораторная работа №14 определение растворимости и произведения растворимости труднорастворимых соединений методом измерения эдс
- •Общие указания по составлению отчетов к лабораторным работам
2.1. Методы измерения электрической проводимости
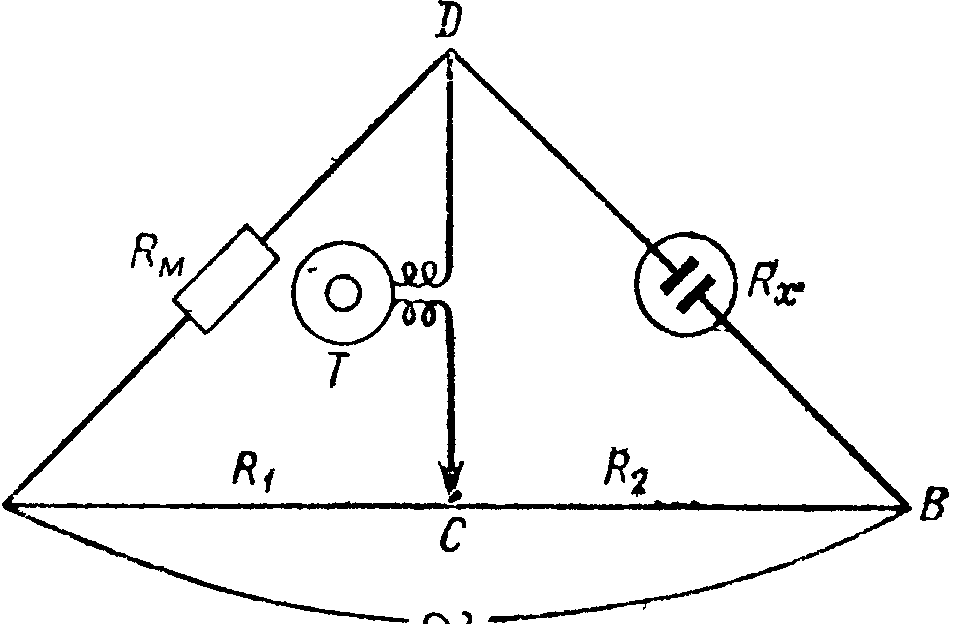
Электрическую проводимость растворов электролитов определяют по результатам измерений с помощью мостика Кольрауша (рис. 7) или с использованием переменнотоковой схемы, приведенной на рис. 8. Источник тока замыкают на постоянное сопротивление, например, на однородную проволоку АВ, натянутую на линейку длиной 50 – 100 см (рис.7). Иногда проволоку наматывают на барабан, причем ее длина может доходить до 3 м. Этим достигается большая точность отсчетов, но прямая проволока предпочтительнее, вследствие уменьшения помех, связанных с емкостью и самоиндукцией. Проволоку изготовляют из манганина (сплава Сu, Мn и Ni), константана (сплава содержащего 40–45% Ni, 1–2% Мn и 59–53% Сu) или другого сплава, стойкого на воздухе, обладающего достаточным сопротивлением и малым температурным коэффициентом сопротивления.
По закону Кирхгофа в точке А мостика ток разветвляется и идет по АСВ и АDВ. Можно найти такое положение контакта С, при котором ток через ветвь СD (диагональ моста) не идет. Это происходит при равенстве потенциалов в точках С и D, чему отвечает условие равенства падения напряжения на участках АС и АD и, соответственно, на участках СВ и DВ.
|
|
Рис. 7. Схема установки для определения электропроводности (мостик Кольрауша): АВ – измерительная проволока (реохорд); R1 и R2 – плечи мостика; С – подвижный контакт; Т – нуль-инструмент; RM – магазин сопротивлений; RX – сосуд с раствором электролита |
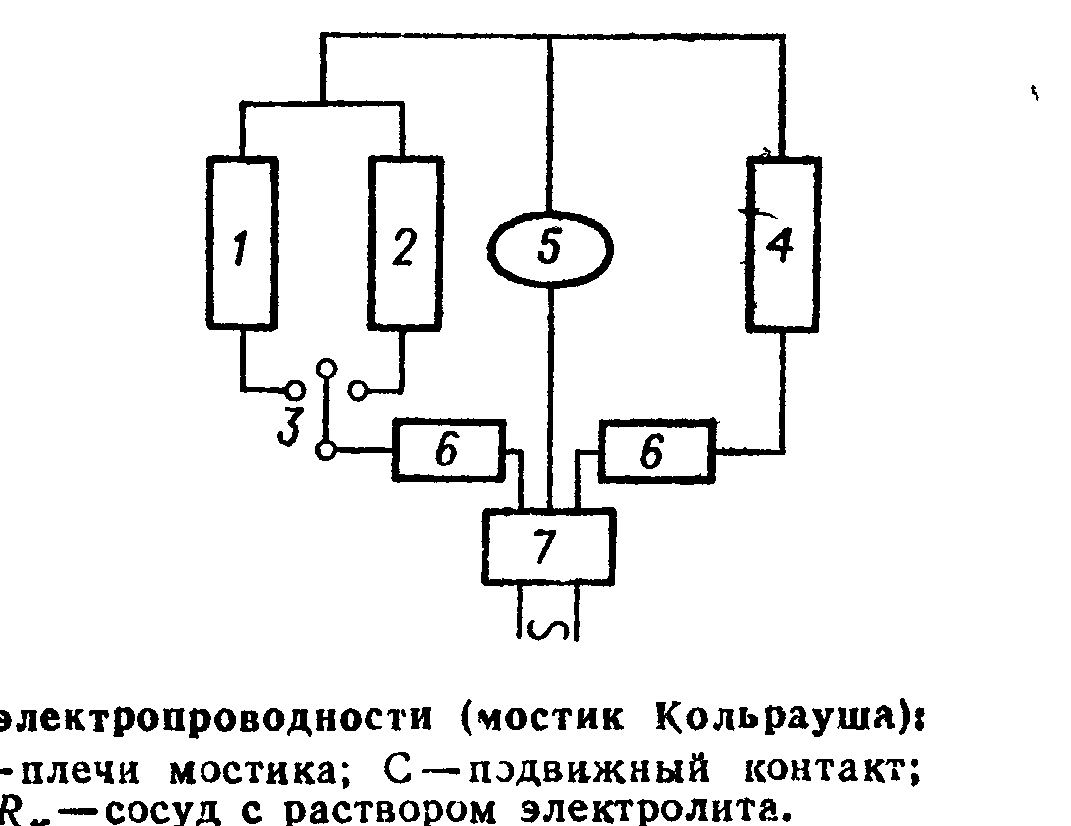
Рис. 8. Мост переменного тока для измерения сопротивлений растворов электролитов: 1 – магазин емкостей; 2 – магазин сопротивлений; 3 – переключатель; 4 – определяемое сопротивление; 5 – индикатор нуля; 6 – постоянные и равные сопротивления плеч моста; 7 – источник питания (генератор звуковой частоты, например ГЗ-33). |
Обозначив силу тока в ветви АDВ через I1, а в ветви АСВ через I2, и выразив падение напряжения на участках цепи через произведение силы тока на соответствующие сопротивления, получаем I1RM = I2R1 и I1RX = I2R2, откуда RM / RX = R1 / R2 .Сечение измерительной проволоки по всей длине одинаково, поэтому сопротивление любого ее отрезка пропорционально его длине. Отсюда
R1 / R2 = АС / СВ = l1 / l2 и RX = RM l2/ l1 (2.27)
Во избежание электролиза, влекущего за собой изменение концентрации электролита, и поляризации электродов, необходимо при измерениях применять ток высокой частоты. Такой ток получают с помощью генератора звуковых частот (например, ГЗ-33). В качестве нуль-инструмента (индикатора) в диагональ моста чаще всего вводят осциллограф.
В мостике переменного тока достигнуть полного равенства потенциалов в точках С и D нельзя, потому что в цепи переменного тока, кроме активного омического сопротивления R существует реактивное сопротивление RCL. Последнее состоит из сопротивления емкости 1/iωС и индуктивного iωL, где ω – частота переменного тока; С – емкость; L – индуктивность; i– оператор, соответствующий сдвигу фаз между током и напряжением на 90°. Полное сопротивление (импеданс) ветви Z = R + RCL. Равновесие в этом случае определяется отношением не сопротивлений, а импедансов: ZM / ZX = Z1 / Z2 Для того чтобы добиться полного равенства потенциалов в точках С и D, нужно по мере возможности устранить реактивные сопротивления в отдельных ветвях измерительного контура. Для этого следует брать короткие соединительные провода, контакты тщательно зачищать и припаивать, ветви мостика экранировать, а экран заземлять. Однако все эти меры не устраняют емкостного сопротивления электрической ячейки.
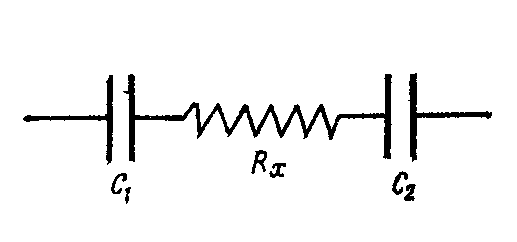
Система из двух электродов, находящихся в растворе, может быть представлена следующей эквивалентной электрической схемой (рис. 9), где RX – омическое сопротивление (величина, которую мы определяем), а С1 и C2 – емкости на поверхности раздела электрод – электролит, следовательно, импеданс
ZX = RX + 1/iωС1+ 1/iωС2 (2.28)
Сопротивления RM, R1 и R2 являются омическими, так что соотношению импедансов можно придать следующий вид:
 (2.29)
(2.29)
Обычно Rx > (1/iωС1 + 1//iωС2), поэтому Zx = Rx и для расчетов можно пользоваться уравнением:
Rх= Rм·R2 / R1= Rм l2 / l1 (2.30)
|
Рис. 9. Эквивалентная электрическая схема ячейки для измерения электрической проводимости: Rx – омическое сопротивление; С1 и С1 – емкости. |
При точных измерениях емкостные сопротивления компенсируют с помощью дополнительного конденсатора переменной емкости, включенного в ветвь постоянного сопротивления 6 (см. рис. 8).
Для измерения электрической проводимости растворов используют ячейки либо с прочно закрепленными платиновыми электродами (рис. 10), либо с электродами, погруженными в ячейку на время работы.
Рис. 10. Ячейки для определения электрической проводимости растворов |
Для получения точных и воспроизводимых измерений электро-
ды платинируют (электролитическим путем наносят на их поверхность платину, см. приложение 1). Площадь электродов и расстояние между ними подбирают в зависимости от значения измеряемого сопротивления. Чем больше сопротивление (меньше электрическая проводимость), тем большую поверхность должны иметь электроды и тем меньше должно быть расстояние между ними.
|
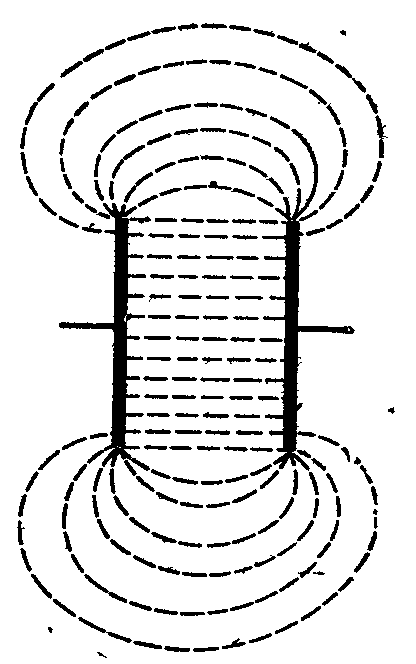
Рис. 11. Распределение силовых линий тока в ячейке для определения электрической проводимости |
проводят не только ионы, заключенные в объеме между электродами (рис. 11). Поэтому удельная электрическая проводимость даже при l = 1 см и S = 1 см 2 не равна электрической проводимости Ω, а лишь пропорциональна ей:
æ = k Ω = k / R (2.31)
Коэффициент пропорциональности k (м–1) называют постоянной ячейки, ее значение зависит от отношения l/S [см. уравнение (2.2)] и фактора f геометрии электродной системы. Чтобы найти значение константы ячейки измеряют сопротивление R стандартных растворов электролитов, чаще всего KCl или NaCl с известной электрической проводимостью при нескольких концентрациях (таблица 1)
Таблица 1.
Удельная электропроводность водных растворов хлористого калия, Ом∙см–1
Температура, °С |
Удельная электропроводность при концентрации С, моль экв/дм3 |
||
|
0,1 |
0,02 |
0,01 |
15 |
0,01048 |
0,002243 |
0,001147 |
16 |
0,01072 |
0,002294 |
0,001173 |
17 |
0,01095 |
0,002345 |
0,001199 |
18 |
0,01119 |
0,002397 |
0,001225 |
19 |
0,01143 |
0,002449 |
0,001251 |
20 |
0,01167 |
0,002501 |
0,001278 |
21 |
0,01191 |
0,002553 |
0,001305 |
22 |
0,01215 |
0,002606 |
0,001332 |
23 |
0,01239 |
0,002659 |
0,001359 |
24 |
0,01264 |
0,002712 |
0,001386 |
25 |
0,01288 |
0,002765 |
0,001417 |
Растворы, как для определения константы ячейки, так и для измерения электрической проводимости, следует готовить посредством последовательного разбавления. Например, если для измерений необходимы растворы с концентрацией 0,1; 0,05; 0,01; 0,001 М, то следует приготовить самый концентрированный раствор 0,1 М, а из него – 0,05 М (разбавив вдвое раствор 0,01М), из раствора 0,05 М следует приготовить 0,01 М раствор и т. д. При таком способе приготовления растворов отмеряемые объемы достаточно велики и ошибка при разбавлении существенно уменьшается.
Ячейку для измерения проводимости ополаскивают дистиллированной водой и 2–3 раза исследуемым раствором. Затем наливают такое количество раствора, чтобы уровень жидкости превышал на 3–5 мм верхний край электродов. При всех измерениях объем жидкости в сосуде должен быть одним и тем же, поэтому наполнять сосуд следует с помощью пипетки. Сосуд с раствором помещают в термостат и выдерживают 10–15 мин.
Общее сопротивление раствора внутри сосуда должно быть не менее 1 000 и не более 5 000 Ом, так как иначе возникнут затруднения, связанные с поляризацией электрода.
Так как электропроводность растворов меняется в больших пределах, то и сосуды для разных электролитов используют разные. Для растворов с большой электропроводностью могут применяться электроды небольшой площади, достаточно далеко отстоящие друг от друга (рис. 10). При низкой проводимости растворов необходимо использовать сосуд с электродами большей площади, максимально приближенными друг к другу.