- •Прохождение тока в электрохимических системах. Законы фарадея
- •Лабораторная работа №2 электровесовой метод анализа
- •Лабораторная работа №3 кулонометрический метод анализа
- •2. Электрическая проводимость растворов электролитов
- •2.1. Методы измерения электрической проводимости
- •Лабораторная работа №4 измерение проводимости растворов электролитов различной концентрации
- •Лабораторная работа №5 определение температурного коэффициента электропроводности электролитов
- •Лабораторная работа № 6 определение растворимости и произведения растворимости труднорастворимой соли
- •Лабораторная работа № 7 определение константы дисоциации слабого электролита
- •Лабораторная работа № 8
- •3. Числа переноса ионов и методы их определения
- •Лабораторная работа №9 определение чисел переноса методом гитторфа
- •5. Электрохимические системы в равновесном состояни
- •Лабораторная работа № 10
- •Лабораторная работа № 11 измерение температурного коэффициента эдс гальванического элемента и расчет термодиинамических величин
- •1. Общие положения
- •2. Порядок выполнения работы
- •Лабораторная работа №12 определение константы нестойкости комплексных ионов меди
- •Лабораторная работа №13 определение стандартной эдс цепи без переноса
- •Лабораторная работа №14 определение растворимости и произведения растворимости труднорастворимых соединений методом измерения эдс
- •Общие указания по составлению отчетов к лабораторным работам
Лабораторная работа № 11 измерение температурного коэффициента эдс гальванического элемента и расчет термодиинамических величин
Цель работы: приготовление гальванического элемента и измерение его ЭДС при различных температурах; вычисление температурного коэффициента dE/dТ, a также расчет изменения энтальпии, энтропии и изобарно-изотермического потенциала реакции, протекающей в элементе.
Оборудование: высокоомный вольтметр или иономер типа И–130, И–150; термостат; стеклянные сосуды; реактивы, электроды.
1. Общие положения
При работе гальванического элемента химическая энергия частично или полностью переходит в электрическую работу. Получаемая работа А при постоянной температуре и давлении будет максимальной полезной работой.
Работа А, кДж, если величину ее отнести к превращению одного моля вещества составит
A = –ΔG = zFE, (5. 18)
где ΔG – изменение изобарно-изотермического потенциала в ходе реакции в элементе; z – число моль экв электронов, принимающих участие в суммарной электрохимической реакции; F – число Фарадея; Е – ЭДС гальванического элемента.
Из уравнения (5.18) и уравнения Гиббса-Гельмгольца
![]() (5.19)
(5.19)
следует, что
![]() .
(5.20)
.
(5.20)
При dE/dT = 0, т. е. когда э. д. с. элемента не зависит от температуры, изменение энтальпии в ходе реакции характеризует электрическую работу, т.е. химическая энергия полностью превращается в электрическую.
Если dE/dT > 0, то получаемая работа больше энергии, высвобождающейся в ходе реакции, и недостаток химической энергии поступает из окружающей среды. Если доступ тепла извне затруднен, то элемент при работе будет охлаждаться. Известны гальванические элементы, в которых протекающая реакция является эндотермической ΔH > 0, dE/dT > 0. В таких элементах, очевидно, максимально полезная работа полностью производится за счет энергии окружающей среды.
При dE/dT < 0, получаемая работа меньше энергии, поставляемой реакцией; часть энергии будет выделяться в виде теплоты. Если отдача тепла элементом затруднительна, то элемент при работе будет нагреваться.
Пользуясь уравнением (5.20), можно вычислить изменение энтальпии ΔН для реакции, протекающей в элементе, если известны E и dE/dT.
Сопоставляя уравнения (5.18) и (5.20) с уравнением
![]() ,
(5.21)
,
(5.21)
следует, что изменение энтропии
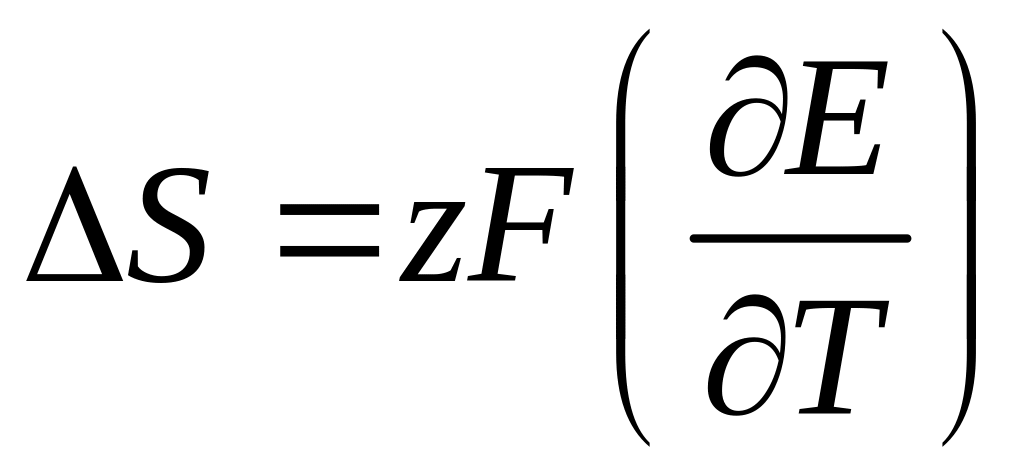 (5.22)
(5.22)
2. Порядок выполнения работы
В работе может быть использован гальванический элемент следующего вида:
![]()
|
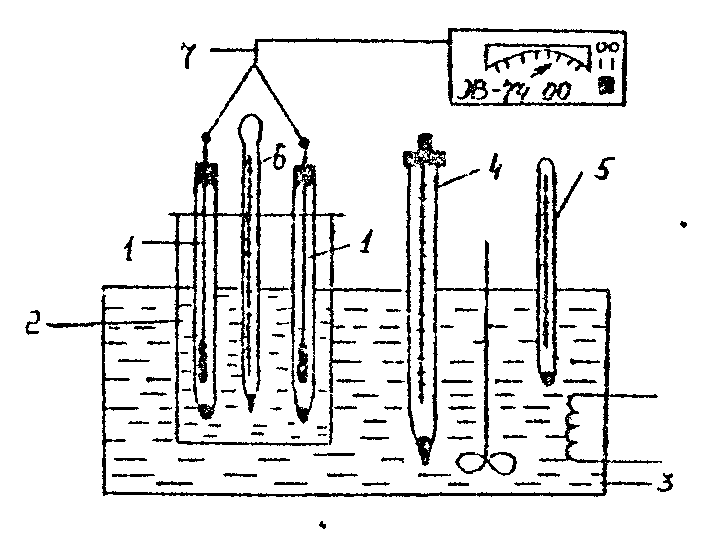
Рис. 22. Схема установки: 1 – электроды; 2 – стакан с KNO3; 3 – термостат; 4 – контактный термометр; 5, 6 – контрольные термометры; 7 – иономер или цифровой вольтметр. |
Приготовленный элемент помещают в термостат, установленный на самую низкую температуру, и выдерживают в нем 15–20 мин (предварительно необходимо ознакомиться с работой термостата). Подключают высокоомный вольтметр, измеряют ЭДС с точностью ±1 мВ. При данной температуре измерения проводят 2–3 раза через 5–6 мин до постоянства значения ЭДС.
Аналогичные опыты проводят при других температурах (не менее 5 значений) с интервалом 7–10°С. По заданию преподавателя могут быть использованы другие гальванические элементы. Опытные и расчетные данные заносят в таблицу:
T, К |
E, В |
ΔE/ΔT |
ΔH, кДж |
ΔG, кДж |
ΔS, Дж/К |
|
|
|
|
|
|
На основании опытных данных строят график зависимости ЭДС от температуры, из которого вычисляют значения dЕ/dТ. Величины ΔН, ΔG и ΔS вычисляют соответственно по уравнениям (5.19), (5.20), (5.22).
Вопросы для самоконтроля
1. Определение термодинамически обратимой системы. 2. Связь электрической энергии с термодинамическими характеристиками электрохимических обратимых систем. 3. Уравнение Гиббса-Гельмгольца. Вывод термодинамического уравнения для обратимой э. д. с. электрохимической системы. 4. Механизм образования э. д. с. и природа электродного потенциала. 5. Внешний, внутренний и поверхностный потенциалы. Гальвани- и вольта- потенциалы, физическая и химическая теория э. д. с.. 6. Природа скачков потенциала. Контактный потенциал. 7. Правила измерения э.д.с. 8. Диаграмма термодинамической устойчивости воды. Диаграмма Пурбе.