
- •Стартовый рейтинг.
- •1.Основные понятия химии.
- •2. Номенклатура неорганических соединений.
- •3. Свойства неорганических соединений.
- •5. Написать структурные формулы органических соединений, указать класс соединения и его функциональную группу:
- •Основные понятия химии.
- •2. Номенклатура неорганических соединений
- •2А. Составить формулы, указать класс соединений:
- •2Б. Назвать соединения, указать класс соединений:
- •3. Свойства неорганических соединений
- •3А. Определить тип оксида и написать формулу соответствующего гидроксида
- •3Б. Указать, какие кислоты образуют кислые соли и составить формулы солее:
- •3В. Указать основания, образующие основные соли и составить формулы солей
Стартовый рейтинг.
Вариант 0.
Вещество (при н.у.) |
Молярная масса, г/моль |
Масса, г |
Молярный объем, л/моль |
Объем, л |
Количество вещества, моль |
Число структурных единиц |
Pb |
|
6,21 |
|
|
|
|
SO2 |
|
|
|
4,48 |
|
|
1.Основные понятия химии.
Заполните таблицу.
2. Номенклатура неорганических соединений.
а) Укажите класс соединений и составьте эмпирические формулы соединений, соответствующие названиям:
сульфид кадмия |
оксид титана (IV) |
гидросульфид калия |
нитрат гидроксоолова(II) |
|
фосфористая кислота |
б) Назовите соединения и укажите класс:
Ca3(PO4)2 FeOHSO3 Co(OH)3 HClO4 Ba(HCO3)2
3. Свойства неорганических соединений.
а) Какие из указанных оксидов являются основными, кислотными и амфотерными (приведите формулы соответствующих им гидроксидов (кислот и оснований): GeO2 Cr2O3 SiO2 Na2O CaO
Заполните таблицу.
Типы оксидов |
Формулы оксидов |
Формулы соответствующих гидроксидов |
Кислотные |
|
|
Основные |
|
|
Амфотерные |
|
|
б) Какие из указанных кислот образуют кислые соли? Составьте формулы этих солей: HPO3 H2S HNO2 HClO3 H3AsO3
в) Какие из указанных оснований образуют основные соли? Составьте формулы этих солей: Cu(OH)2 KOH Mg(OH)2 NaOH Fe(OH)2
4. Осуществить превращения: Zn ---- ZnO ---- ZnSO4 ----- Zn(NO3)2 ---- O2
5. Написать структурные формулы органических соединений, указать класс соединения и его функциональную группу:
а) 3-метилбутадиен-1,2; б) метиловый эфир трихлоруксусной кислоты; в) 2,6-динитроанилин.
Образец решения некоторых заданий стартового рейтинга
Основные понятия химии.
Заполните таблицу.
Вещество (агрегат. состояние при н.у.) |
Молярная масса
|
Масса m, г |
Молярный объем,
|
Объем V, л |
Количество
вещества
|
Число структурных единиц N |
|
|
|
|
|
|
дано |
|
|
дано |
|
|
|
|
|
|
|
|
|
дано |
|
|
|
|
|
дано |
|
|
M
– молярная масса вещества или масса 1
моль вещества. Рассчитывается по таблице
Менделеева, измеряется в
![]()
ν или n – количество вещества, измеряется в моль.
Для расчетов применяются формулы:
для веществ в любом агрегатном состоянии
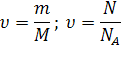
V
только для газов ν = -----
VM
m – масса вещества в г (граммах)
N – число структурных единиц (молекул, атомов или сочетание ионов)
NA – постоянная (или число) Авогадро, показывает, сколько структурных единиц
содержится в 1 моль любого вещества.
![]()
V – объем газа в л (литрах)
VM
– молярный объем любого газ, т.е. объем
1 моль газа, измеряется в
![]() .
.
При н.у.
![]()
Используя три формулы для расчета количества вещества (ν или n) , заполним таблицу.
Вещество (агрегатное состояние при н.у.) |
Молярная масса |
||||
Al2(SO4)3 Соль, твердое вещество при н.у. |
1)
по табл. Менделеева
|
||||
Масса m, г |
Молярный объем,
|
Объем V, л |
|
||
|
при данных условиях невозможно определить, т.к. твердое вещество |
|
|||
Количество вещества , моль |
Число структурных единиц N |
|
|||
2)
|
дано
|
|
|||
Вещество (агрегатное состояние при н.у.) |
Молярная масса |
Масса m, г |
Молярный объем,
|
||
H2S Сероводород при н.у. - газ |
1) по табл. Менделеева
|
дано |
3) при н.у. для любого газа
|
||
Объем V, л |
Количество вещества , моль |
|
|||
4)
|
2)
|
|
|||
Число структурных единиц N |
|
||||
5)
|
|
||||
Вещество (агрегатное состояние при н.у.) |
Молярная масса |
Масса m, г |
|
|||
Br2 Бром, при н.у. - жидкость |
1) по табл. Менделеева Г М(Br2) = 2∙М(Br) = 2∙ 80 = 160 ------ МОЛЬ |
2)
|
|
|||
Молярный объем,
|
Объем V, л |
Количество вещества , моль |
Число структурных единиц N |
|||
при данных условиях невозможно определить, т.к. жидкое вещество |
дано |
3)
|
||||
Вещество (агрегатное состояние при н.у.) |
Молярная масса |
Масса m, г |
|||
ClO2 Оксид хлора (IV), при н.у. газ желто-бурого цвета |
1) по табл. Менделеева
|
4)
|
|||
Молярный объем, |
Объем V, л |
Количество вещества , моль |
Число структурных единиц N |
||
2) при н.у. для любого газа
|
дано |
3)
|
5)
|
||
