- •Содержание
- •Тема 1. Кинетика биологических процессов. 10
- •Вводная тема. Техника безопасности.
- •Контрольные вопросы.
- •Тема 1. Кинетика биологических процессов. Теоретическая часть
- •Экспериментальная часть
- •Задание №l. Определение энергии активации сокращений сердца лягушки по величине q10
- •Задание №2. Определение энергии активации сокращений сердца лягушки с помощью графика Аррениуса.
- •Задание№3. Определение температурного коэффициента гемолиза эритроцитов крови человека
- •Методика выполнения работы.
- •Задание №4. Определение температурного коэффициента и энергии активации фотосинтеза в веточке элодеи
- •Методика выполнения работы.
- •Литература:
- •Контрольные вопросы.
- •Тема 2. Математическое моделирование биофизических процессов. Теоретическая часть
- •Практическая часть
- •Задание 1. Модель естественного роста (модель Мальтуса)
- •Выполнение работы
- •Задание 2. Модель изменения численности популяции с учетом внутривидовой конкуренции (модель Ферхюльста)
- •Выполнение работы
- •Задание 3. Циклические математические модели: модель "хищник-жертва" (модель Вольтера-Лотки)
- •Выполнение работы
- •Литература:
- •Контрольные вопросы.
- •Тема 3. Информация и живой организм. Теория информации. Теоретическая часть
- •Практическая часть Задание 1. Изучение информационно-энтропийных характеристик распределения.
- •Задание 2. Изучение информационно-энтропийных характеристик сердечного ритма
- •Тема 4. Изучение электрической активности органов живых объектов Теоретическая часть
- •Практическая часть Задача 1. Изучение работы электрокардиографа
- •Методика
- •Ход работы
- •Обработка результатов
- •Задача 2. Регистрация ээг человека и ее изменений при различных функциональных пробах.
- •Методика
- •Ход работы
- •Обработка и обсуждение результатов
- •Литература:
- •Контрольные вопросы.
- •Тема 5. Биофизика рецепции Теоретическая часть
- •Экспериментальная часть Задание 1. Изучение спектральной характеристики уха на пороге слышимости.
- •Подготовка к работе
- •Порядок работы
- •Воздушное звукопроведение
- •Костное звукопроведение
- •Литература:
- •Контрольные вопросы
Контрольные вопросы.
1. Каковы общие требования безопасности при проведении лабораторных работ по биофизике?
2. Каковы общие правила безопасности при работе с химическими веществами?
3. Правила безопасности при работе с центрифугами.
4. Каковы основные типы поражения электрическим током?
5. Какова зависимость действия тока от его величины?
6. Какие органы критичны по отношению к действию электрическим током?
7. Какие меры первой помощи оказываются пострадавшему.
Тема 1. Кинетика биологических процессов. Теоретическая часть
Все биологические процессы протекают во времени. Для описания и оценивания этого удобной количественной характеристикой является скорость реакции или скорость процесса. Знание механизмов реакций и процессов, обеспечивающих их протекание с той или иной скоростью, зависимость скорости от различных факторов (концентрации веществ, температуры, рН, наличия катализаторов-ферментов, активаторов, ингибиторов и т.д.) позволяет прогнозировать развитие реакций или процессов, оптимизировать их протекание в нужном направлении и с необходимым результатом.
Представим химическое превращение в виде простой реакции:
![]()
Скоростью этой химической реакции будет величина накопления продукта в единицу времени
![]() ;
;
Кинетика базируется на фундаментальном положении Гулдберга-Вааге, согласно которому скорость реакции пропорциональна произведению концентраций реагирующих веществ в степенях, соответствующих их стехиометрическим коэффициентам. Это положение, связывающее активные концентрации веществ со скоростью реакции, так же известно как закон действующих масс. В соответствие с этим законом скорость реакции может быть выражена в следующем виде:
![]()
где к – коэффициент пропорциональности, называемый константа скорости реакции.
Рассмотрим вариант
простейшей реакции 1 -го порядка, когда
Скорость реакции в этом случае можно
выразить как![]()
Знак минус на расходование реагента в ходе реакции.
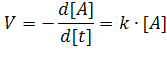
Пусть в начальный момент времени t=0 концентрация вещества А равна [А]0. После начала реакции начнется постепенное расходование реагента А и к моменту времени t = t его концентрация станет [А]. Используя эти граничные условия, проинтегрируем уравнение скоростей, предварительно разделим переменные
![]() ;
;
![]() ;
;
![]() ;
;
Отсюда или ![]() или
или ![]() ;
;
Из этого уравнения
после потенцирования выражение для
зависимости| изменения концентрации
вещества от времени ![]()
При переходе к
десятичным логарифмам
получается ![]() ;
;
Отсюда определяется
константа скорости 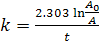 , где [А]0 и [А] - начальная и
конечная концентрации вещества А.
, где [А]0 и [А] - начальная и
конечная концентрации вещества А.
Помимо зависимости
от концентрации реагентов скорость
реакции существенно зависит от
температуры. Известно эмпирическое
правило, называемое законом Вант-Гоффа,
согласно которому при повышении
температуры на 10° скорость реакции
возрастает приблизительно в 2 раза.
Отношение констант скоростей реакции
при двух температурах, различающихся
на 10°, называется температурным
коэффициентом ![]() .
.
Правило Вант-Гоффа
приближенное, поскольку температурный
коэффициент Q10 меняется с
температурой. Более точная зависимости
скорости реакции (константы скорости)
от температуры выражается уравнением
Аррениуса, которое учитывает кинетическую
энергию реагентов, определяющих характер
влияния на скорость реакции: ![]() ,
где А — предэкспоненциальный множитель,
Т — абсолютная температура (К), R —
универсальная газовая постоянная
(1.98•10-3 ккал/М•градус), Еа
- энергия активации. Она характеризует
величиной энергетического потенциального
барьера, который молекулы реагентов
должны преодолеть для взаимодействия.
,
где А — предэкспоненциальный множитель,
Т — абсолютная температура (К), R —
универсальная газовая постоянная
(1.98•10-3 ккал/М•градус), Еа
- энергия активации. Она характеризует
величиной энергетического потенциального
барьера, который молекулы реагентов
должны преодолеть для взаимодействия.
Для любого
температурного интервала Q10
вычисляется по формуле Вант-Гоффа: ![]() ,
где К1 и К2 константы скорости
реакции при температурах t1 и t2
соответственно.
,
где К1 и К2 константы скорости
реакции при температурах t1 и t2
соответственно.
Очевидно при t2
= t1 + 10, ![]() ;
; ![]() (пpи
(пpи ![]() )
)
При изучении биологических процессов вычисление К обычно затруднительно и ее заменяют непосредственно величиной скорость процесса. Энергия активации, т.е. температурная характеристика процесса выводится из уравнения Аррениуса для скорости химической реакции:
![]() ,
где Ea
- энергия активации.
,
где Ea
- энергия активации.
Из уравнения
следует: ![]() .
.
Формула устанавливает
простое соотношение между Еа и
Q10. Действительно, при T2-T1=10
и при переходе от ln к lg
путем умножения на модуль 2,3 имеем: ![]() [кал/град•моль].
[кал/град•моль].
Энергия активации связана с температурным коэффициентом эмпирическим соотношением:
Прологарифмировав
интегральное уравнение Аррениуса,
получим выражение, удобное для определения
величины энергии активации из
экспериментально полученных величин:
![]()
Из этого выражения
следует, что ![]() (или
(или ![]() )
линейно зависит от величины обратной
температуры (1/Т) (рис.1.1). Это очень удобно
для графического представления
кинетических экспериментальных данных.
Если по оси ординат откладывать значения
(или
),
а по оси абсцисс -1/Т (координаты Аррениуса),
то из наклона этого графика легко
определяется величина энергии активации
Еа.
)
линейно зависит от величины обратной
температуры (1/Т) (рис.1.1). Это очень удобно
для графического представления
кинетических экспериментальных данных.
Если по оси ординат откладывать значения
(или
),
а по оси абсцисс -1/Т (координаты Аррениуса),
то из наклона этого графика легко
определяется величина энергии активации
Еа.
![]() отсюда
отсюда ![]() ;
;
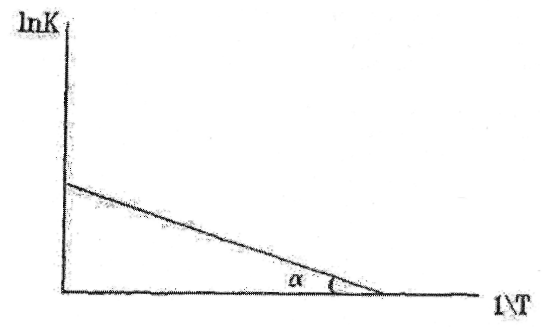
Рис. 1.1. Диаграмма Аррениуса (представление экспериментальных данных в координатах Аррениуса).
Наиболее точно зависимость константы скорости реакции от температуры определяется на основе теории абсолютных скоростей реакций Эйринга. Эта зависимость выражается уравнением Эйринга:
![]() ,
где к0 - постоянная Больцмана
1.88*10-23 Дж/К; h - постоянная Планка 6.625*10-34
Дж*сек;
,
где к0 - постоянная Больцмана
1.88*10-23 Дж/К; h - постоянная Планка 6.625*10-34
Дж*сек; ![]() —
изменение энтропии и энтальпии
соответственно в результате химического
превращения или процесса.
—
изменение энтропии и энтальпии
соответственно в результате химического
превращения или процесса.
|
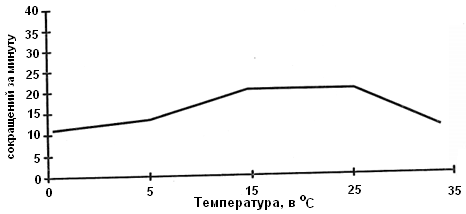
Рис. 1.2. Примерный вид зависимости ЧСС от температуры. |