
- •Закон объемных отношений (Гей-Люссак, 1808 г.)
- •Заселение атомных орбиталей электронами. Правило минимума энергии, принцип Паули и правило Хунда
- •Электронные конфигурации атомов
- •Формулировка правила Клечковского
- •Исключения из правила Клечковского
- •Свойства ионной связи
- •9) Периодический закон д. И. Менделеева и периодическая система элементов
- •10) Классификация неорганических соединений
- •Классификация
- •[Править]По заряду комплекса
- •[По числу мест, занимаемых лигандами в координационной сфере
- •]По природе лиганда
- •12) Реакции ионного обмена и условия их протекания до конца
- •Правила написания уравнений реакций в ионном виде
- •Условия, при которых реакции ионного обмена протекают до конца
- •1. Если в результате реакции выделяется малодиссоциирующее вещество – вода.
- •2. Если в результате реакции выделяется нерастворимое в воде вещество.
- •3. Если в результате реакции выделяется газообразное вещество.
- •Запись сложных химических уравнений реакций в ионном виде
- •14) Окислительно-восстановительные реакции Степень окисления
- •Расчет степени окисления
- •Окислительно-восстановительные свойства вещества и степени окисления входящих в него атомов
- •Важнейшие восстановители и окислители
- •Классификация окислительно-восстановительных реакций Межмолекулярные окислительно-восстановительные реакции
- •Внутримолекулярные окислительно- восстановительные реакции
- •Составление уравнений окислительно-восстановительных реакций
- •Типичные реакции окисления-восстановления Реакции с участием перманганата калия в качестве окислителя
- •Реакции в кислой среде.
- •Реакции в нейтральной среде
- •Реакции в щелочной среде.
- •Реакции с дихроматом калия в качестве окислителя
- •Окислительные свойства азотной кислоты
- •Пероксид водорода в окислительно-восстановительных реакциях
10) Классификация неорганических соединений
В настоящее время известно более 118 химических элементов: по различным источникам, в природе встречаются от 88 до 94. Химические элементы образуют огромное количество неорганических соединений. Хотя каждому соединению присущи свои особенности, свои специфические свойства, имеется целый ряд веществ с некоторыми сходными, общими свойствами. Исходя из общности свойств, соединения объединяют в группы, классы, то есть классифицируют их, что облегчает изучение многообразия веществ.
 Вспомним,
что, исходя их состава молекул, вещества
делятся на простые и сложные.
Вспомним,
что, исходя их состава молекул, вещества
делятся на простые и сложные.
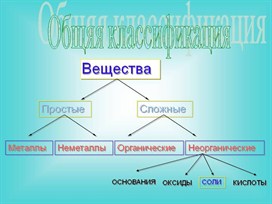
Простые вещества – вещества, молекулы которых состоят из атомов одного вида (атомов одного элемента). В химических реакциях не могут разлагаться с образованием других веществ. Сложные вещества (или химические соединения) – вещества, молекулы которых состоят из атомов разного вида (атомов различных химических элементов). В химических реакциях разлагаются с образованием нескольких других веществ.
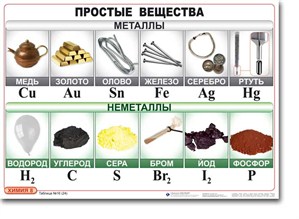
Простые вещества разбиваются на две большие группы: металлы и неметаллы.
Металлы – группа элементов, обладающая характернымиметаллическими свойствами: твёрдые вещества (исключение составляет ртуть) имеют металлический блеск, являются хорошими проводниками теплоты и электричества, ковкие (железо (Fe), медь (Cu), алюминий (Al), ртуть (Hg), золото (Au), серебро (Ag) и др.).
Неметаллы – группа элементов: твёрдые, жидкие (бром) и газообразные веществ, которые не обладают металлическим блеском, являются изоляторы, хрупкие.
 А
сложные вещества в свою очередь
подразделятся на четыре группы, или
класса: оксиды, основания, кислоты и
соли.
А
сложные вещества в свою очередь
подразделятся на четыре группы, или
класса: оксиды, основания, кислоты и
соли.
Оксиды – это сложные вещества, в состав молекул которых входят атомы кислорода и какого – нибудь другого вещества.
Основания – это сложные вещества, в которых атомы металлов соединены с одной или несколькими гидроксильными группами.
С точки зрения теории электролитической диссоциации, основания – сложные вещества, при диссоциации которых в водном растворе образуются катионы металла (или NH4+) и гидроксид – анионы OH-.
Кислоты – это сложные вещества, в состав молекул которых входят атомы водорода, способные замещаться или обмениваться на атомы металла.
Соли – это сложные вещества, молекулы которых состоят из атомов металлов и кислотных остатков. Соль представляет собой продукт частичного или полного замещения атомов водорода кислоты металлом.
Соли - это сложные вещества, состоящие из одного (нескольких) атомов металла (или более сложных катионных групп, например, аммонийных групп NН4+, гидроксилированных групп Ме(ОН)nm+) и одного (нескольких) кислотных остатков. Общая формула солей МеnАm, где А - кислотный остаток. Соли (с точки зрения электролитической диссоциации) представляют собой электролиты, диссоциирующие в водных растворах на катионы металла (или аммония NН4+) и анионы кислотного остатка.
Классификация. По составу соли подразделяют на средние (нормальные), кислые (гидросоли), основные(гидроксосоли), двойные, смешанные и комплексные (см. таблицу).
Таблица - Классификация солей по составу
СОЛИ |
|||||
Средние (нормальные) -продукт полного замещения атомов водорода в кислоте на металл AlCl3 |
Кислые(гидросоли)- продукт неполного замещения атомов водорода в кислоте на металл КHSO4 |
Основные(гидроксосоли)-продукт неполного замещения ОН-групп основания на кислотный остаток FeOHCl |
Двойные -содержат два разных металла и один кислотный остаток КNaSO4 |
Смешанные -содержат один металл и несколько кислотных остатков CaClBr |
Комплексные [Cu(NH3)4]SO4 |
11) Комплексные соединения (лат. complexus — сочетание, обхват) или координационные соединения (лат. co — «вместе» иordinatio — «упорядочение») — частицы (нейтральные молекулы или ионы), которые образуются в результате присоединения к данному иону (или атому), называемому комплексообразователем, нейтральных молекул или других ионов, называемыхлигандами. Теория комплексных соединений (координационная теория) была предложена в 1893 г. А. Вернером.
Комплексные соединения мало диссоциируют в растворе (в отличие от двойных солей). Комплексные соединения могут содержать комплексный малодиссоциирующий анион ([Fe(CN)6]3−), комплексный катион ([Ag(NH3)2]+), либо вообще не диссоциировать на ионы (соединения типа неэлектролитов, например карбонилы металлов). Комплексные соединения разнообразны и многочисленны.
