
- •Закон объемных отношений (Гей-Люссак, 1808 г.)
- •Заселение атомных орбиталей электронами. Правило минимума энергии, принцип Паули и правило Хунда
- •Электронные конфигурации атомов
- •Формулировка правила Клечковского
- •Исключения из правила Клечковского
- •Свойства ионной связи
- •9) Периодический закон д. И. Менделеева и периодическая система элементов
- •10) Классификация неорганических соединений
- •Классификация
- •[Править]По заряду комплекса
- •[По числу мест, занимаемых лигандами в координационной сфере
- •]По природе лиганда
- •12) Реакции ионного обмена и условия их протекания до конца
- •Правила написания уравнений реакций в ионном виде
- •Условия, при которых реакции ионного обмена протекают до конца
- •1. Если в результате реакции выделяется малодиссоциирующее вещество – вода.
- •2. Если в результате реакции выделяется нерастворимое в воде вещество.
- •3. Если в результате реакции выделяется газообразное вещество.
- •Запись сложных химических уравнений реакций в ионном виде
- •14) Окислительно-восстановительные реакции Степень окисления
- •Расчет степени окисления
- •Окислительно-восстановительные свойства вещества и степени окисления входящих в него атомов
- •Важнейшие восстановители и окислители
- •Классификация окислительно-восстановительных реакций Межмолекулярные окислительно-восстановительные реакции
- •Внутримолекулярные окислительно- восстановительные реакции
- •Составление уравнений окислительно-восстановительных реакций
- •Типичные реакции окисления-восстановления Реакции с участием перманганата калия в качестве окислителя
- •Реакции в кислой среде.
- •Реакции в нейтральной среде
- •Реакции в щелочной среде.
- •Реакции с дихроматом калия в качестве окислителя
- •Окислительные свойства азотной кислоты
- •Пероксид водорода в окислительно-восстановительных реакциях
А́том (от др.-греч. ἄτομος — неделимый) — наименьшая химически неделимая часть химического элемента, являющаяся носителем его свойств.
Химический элемент — совокупность атомов с одинаковым зарядом ядра и числом протонов, совпадающим с порядковым (атомным) номером в таблицеМенделеева.
Моле́кула (новолат. molecula, уменьшительное от лат. moles — масса) — электрически нейтральная частица, состоящая из двух или более связанных ковалентными связями атомов, наименьшая частица химического вещества, обладающая всеми его химическими свойствами.
Ио́н (др.-греч. ἰόν — идущее) — одноатомная или многоатомная электрически заряженная частица, образующаяся в результате потери или присоединения атомом илимолекулой одного или нескольких электронов.
2) АВОГА́ДРО ЗАКО́Н, один из основных законов идеальных газов: в равных объемах идеальных газов при одинаковых давлении и температуре содержится одинаковое число молекул. Число молекул в одном моле называют постоянной Авогадро или числом Авогадро. Закон был открыт А. Авогадро в 1811.
Согласно закону Авогадро, 1 моль любого идеального газа при нормальных условиях занимает одинаковый объем. При давлении р =101,325 кПа и температуре Т = 273,15 К этот объем равен 22,41383 м3. Следовательно, моль любого вещества содержит одно и то же число молекул, равное числу Авогадро 6,022045(31).1023 моль-1.
Следствия закона
Первое следствие из закона Авогадро: один моль любого газа при одинаковых условиях занимает одинаковый объём.
В частности, при нормальных условиях, т. е. при 0 °C (273К) и 101,3 кПа, объём 1 моля газа, равен 22,4 л. Этот объём называют молярным объёмом газа Vm. Пересчитать эту величину на другие температуру и давление можно с помощью уравнения Менделеева-Клапейрона:
![]() .
.
Второе следствие из закона Авогадро: молярная масса первого газа равна произведению молярной массы второго газа на относительную плотность первого газа по второму.
Положение это имело громадное значение для развития химии, так как оно дает возможность определять частичный вес[2] тел, способных переходить в газообразное или парообразное состояние. Если через m мы обозначим частичный вес тела, и через d — удельный вес[3] его в парообразном состоянии, то отношение m / d должно быть постоянным для всех тел. Опыт показал, что для всех изученных тел, переходящих в пар без разложения, эта постоянная равна 28,9, если при определении частичного веса исходить из удельного веса воздуха, принимаемого за единицу, но эта постоянная будет равняться 2, если принять за единицу удельный вес водорода. Обозначив эту постоянную, или, что то же, общий всем парам и газам частичный объём через С, мы из формулы имеем с другой стороны m = dC. Так как удельный вес параопределяется легко, то, подставляя значение d в формулу, выводится и неизвестный частичный вес данного тела.
Элементарный анализ, например, одного из полибутиленов указывает, в нём пайное отношение углерода к водороду, как 1 к 2, а потому частичный вес его может быть выражен формулой СН2 или C2H4, C4H8 и вообще (СН2)n. Частичный вес этого углеводорода тотчас определяется, следуя закону Авогадро, раз мы знаем удельный вес, т. е. плотность его пара; он определен Бутлеровым и оказался 5,85 (по отношению к воздуху); т. е. частичный вес его будет 5,85 · 28,9 = 169,06. Формуле C11H22отвечает частичный вес 154, формуле C12H24 — 168, а C13H26 — 182. Формула C12H24 близко отвечает наблюденной величине, а потому она и должна выражать собою величину частицы нашего углеводорода CH2.
Закон объемных отношений (Гей-Люссак, 1808 г.)
"Объемы газов, вступающих в химические реакции, и объемы газов, образующихся в результате реакции, относятся между собой как небольшие целые числа".
Следствие. Стехиометрические коэффициенты в уравнениях химических реакций для молекул газообразных веществ показывают, в каких объемных отношениях реагируют или получаются газообразные вещества.
Примеры.
2CO
+ O2 ![]() 2CO2
2CO2
При окислении двух объемов оксида углерода (II) одним объемом кислорода образуется 2 объема углекислого газа, т.е. объем исходной реакционной смеси уменьшается на 1 объем.
При синтезе аммиака из элементов:
N2 + 3H2 2NH3
Один объем азота реагирует с тремя объемами водорода; образуется при этом 2 объема аммиака - объем исходной газообразной реакционной массы уменьшится в 2 раза.
3)
Эквивалент
химический,
условная частица, в целое число раз
меньшая (или равная) соответствующей
ей формульной единицы - атома, молекулы, иона,
радикала и др. В одной формульной единице
вещества В может содержаться z(B) химических
эквивалентов этого вещества. Число z(B)
(эквивалентное число) показывает, сколько
химических эквивалентов содержится в
одной формульной единице; всегда z(B) ![]() 1.
Значения z(В) зависят от хим. реакции, в
которой данное вещество участвует.
1.
Значения z(В) зависят от хим. реакции, в
которой данное вещество участвует.
В
обменных реакциях значения z(B) определяются
стехиометрией реакции. Напр., для реакции
Al2(SO4)3+12KOH ![]() 2К3[А1(ОН)6]
+ 3K2SO4 на
одну формульную единицу Al2(SO4)3 затрачивается
12 формульных единиц КОН. Следовательно,
значение z[Al2(SO4)3]
= 12, a z(KOH) = 1. Значение химического
эквивалента для Al2(SO4)3 равно 1/12формульной
единицы Al2(SO4)3,
а химический эквивалент КОН равен
формульной единице КОН. В
окислительно-восстановительных реакциях
значение z(B) определяют по числу электронов,
которые принимает одна формульная
единица окислителя или
отдает одна формульная единица восстановителя.
2К3[А1(ОН)6]
+ 3K2SO4 на
одну формульную единицу Al2(SO4)3 затрачивается
12 формульных единиц КОН. Следовательно,
значение z[Al2(SO4)3]
= 12, a z(KOH) = 1. Значение химического
эквивалента для Al2(SO4)3 равно 1/12формульной
единицы Al2(SO4)3,
а химический эквивалент КОН равен
формульной единице КОН. В
окислительно-восстановительных реакциях
значение z(B) определяют по числу электронов,
которые принимает одна формульная
единица окислителя или
отдает одна формульная единица восстановителя.
Например,
в полуреакции ![]() значение
z
значение
z ![]() =
5, а значение химического эквивалента
для анионов МnО-4 равно 1/5 формульной
единицы
=
5, а значение химического эквивалента
для анионов МnО-4 равно 1/5 формульной
единицы ![]() .
.
Количество вещества химического эквивалента вещества В - nэк(В) - величина, пропорциональная числу химических эквивалентов этого вещества Nэк(B):
nэк(B)=Nэк(B)/NA,
где NA - постоянная Авогадро, Единица измерения количества вещества химического эквивалента - моль. Так как в одной формульной единице вещества В может содержаться z(B) химических эквивалентов этого вещества, то
![]()
где Nфе - число формульных единиц вещества В. Следовательно:
![]()
где nв - количество вещества В.
Молярная масса химического эквивалента вещества В - МЭК(В) - это масса вещества В (тв), деленная на количество вещества химического эквивалента:
![]()
Значение МЭК(В) можно найти, исходя из молярной массы вещества В (Мв, г/моль):
![]()
Молярная концентрация химического эквивалента растворенного вещества В - сЭК(В) представляет собой отношение количества вещества Э. х. nЭК(В) к объему раствора Vp:
cЭК(B) = nЭК(B)/Vp
Единица измерения сЭК(В) - моль/л, обозначение этой единицы - "н." (нормальность - число химических эквивалентов растворенного вещества в 1 л раствора). Запись 0,01 н. раствор КМnО4 означает сантинормальный раствр КМnО4, Величина сЭК(В) в конкретной реакции всегда в z(B) раз больше его молярной концентрации св:
![]()
Объем химического эквивалента газообразного вещества В - VЭК(B) представляет собой отношение объема данного газаVВ к количеству вещества химического эквивалента вещества В:
![]()
Единица измерения VЭК(В) - л/моль. Поскольку для газов, принимаемых условно за идеальные, nв = VB/Vn, где Vп =22,414 л/моль, то
![]()
Т. обр., VЭК(B) в конкретной химической реакции, протекающей в нормальных условиях, всегда в z(В) раз меньше объема 1 моля идеального газа.
Закон химических эквивалентов гласит: элементы всегда соединяются между собой в определенных массовых количествах, соответствующих их химическим эквивалентам, или: в реакциях всегда участвуют равные количества вещества химических эквивалентов. Поэтому для реакции, в которой взаимодействуют вещества А и В, будут справедливы равенства:

Раньше под химическим эквивалентом понимали количество вещества, которое присоединяет или замещает 1 моль атомов водорода в ходе хим. реакции. Однако это понятие относится не к самому химическому эквиваленту, а к количеству вещества химического эквивалента взятого вещества В, как это видно из приведенных выше других физических величин, связанных с понятием химический эквивалент Ранее использовали также понятие "грамм-эквивалент", равный химическому эквиваленту, выраженному в граммах.
4) Квантовые числа — энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится.
Главное квaнтовое число n определяет общую энергию электрона и степень его удаления от ядра (номер энергетического уровня); оно принимает любые целочисленные значения, начиная с 1 (n = 1, 2, 3, . . .)
Орбитальное (побочное или азимутальное) квантовое число l определяет форму атомной орбитали. Оно может принимать целочисленные значения от 0 доn-1 (l = 0, 1, 2, 3,..., n-1). Каждому значению l соответствует орбиталь особой формы. Орбитали с l = 0 называются s-орбиталями, l = 1 – р-орбиталями (3 типа, отличающихся магнитным квантовым числом m), l = 2 – d-орбиталями (5 типов), l = 3 – f-орбиталями (7 типов).
Магнитное квантовое число m определяет ориентацию орбитали в пространстве относительно внешнего магнитного или электрического поля. Его значения изменяются от +l до -l, включая 0. Например, при l = 1 число m принимает 3 значения: +1, 0, -1, поэтому существуют 3 типа р-АО: рx, рy, рz.
Спиновое квантовое число s может принимать лишь два возможных значения +1/2 и -1/2. Они соответствуют двум возможным и противоположным друг другу направлениям собственного магнитного момента электрона, называемого спином (от англ. веретено). Для обозначения электронов с различными спинами используются символы:
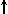 и
и  .
.
Электронное облако — это наглядная модель, отражающая поведение электрона в атоме или молекуле.
В первое время после появления знаменитого волнового уравнения Э. Шрёдингера предпринималось много попыток выяснить возможный физический смысл волновой функции и разработать модель поведения электрона в атоме. Э. Шрёдингер с самого начала говорил о «размазанном электроне», заряд которого также размазан по пространству и распределён по пучностям колебаний, предложил понятие «волнового пакета».
Однако физики отнеслись критически к этой модели. Макс Борн показал, что эти волны следует толковать статистически с точки зрения теории вероятности. Сами же волны не материальны, они лишь математические выражения, которыми описывается вероятность обнаружения электрона в той или иной точке пространства.
В качестве модели состояния электрона в атоме в квантовой механике принято представление об электронном облаке, плотность соответствующих участков которого пропорциональна вероятности обнаружить там электрон в процессе наблюдения. Одна из возможных форм электронного облака в атоме показана на рис.1. Электронное облако окажется наиболее плотным там, где наибольшее число точек, то есть в областях наиболее вероятного обнаружения электрона[1]. Следует отметить, что неверной является интерпретация, согласно которой плотность облака указывает на вероятность нахождения в данной точке электрона, электрон, вообще говоря, не локализован в какой-либо точке пространства.
Имеются и другие способы изображения распределения электронной плотности относительно ядра (рис.2).
Кривая радиального распределения вероятности нахождения электрона в атоме водорода показывает, что вероятность обнаружения электрона максимальна в тонком шаровом слое с центром в точке расположения протона и радиусом, равным боровскому радиусу a0[2].
Более размытое облако плотности вероятности, полученное при квантово-механическом рассмотрении, значительно отличается от результатов теории Бора и согласуется с принципами неопределённости Гейзенберга.[3].
Электронное облако наиболее часто изображают в виде граничной поверхности (охватывающей примерно 90 % электронного облака). При этом обозначение плотности с помощью точек опускают
