
- •Глава 1 введение
- •1.2 Основные сырьевые источники органических соединений
- •1.3 Классификация органических соединений
- •1.4 Номенклатура органических соединений
- •1.4.1 Тривиальная номенклатура
- •1.4.2 Рациональная номенклатура
- •1.4.3 Номенклатура июпак
- •1.4.3.1. Номенклатура июпак для алифатических углеводородов.
- •Глава 2 теоретические представления в органической химии
- •2.1 Типы химических связей
- •2.2 Образование ковалентных связей атомами углерода (σ- и π-ковалентные связи)
- •2.3 Общие представления о механизмах химических реакций
- •2.3.1 Свободнорадикальные реакции
- •2.3.2 Ионные реакции
- •2.4 Пространственное расположение атомов в молекуле. Конформация молекул
- •Глава 3 алифатические углеводороды алканы,алкены, алкины и алкадиены
- •3.1 Алканы: определениек,изомерия и номенклатура
- •3.1.2 Способы получения алканов
- •3.1.3 Химические свойства
- •Радикальное галогенирование
- •Нитрование
- •Сульфирование, сульфоокисление, сульфохлорирование
- •Окисление
- •Крекинг углеводородов при высоких температурах
- •Задачи для самопроверки
- •3.2 Алкены: определение, изомерия, номенклатура
- •3.2.1 Способы получения
- •3.2.2 Химические свойства
- •3.3. Алкадиены: определение, изомерия, номенклатура
- •3.3.1 Способы получения важнейших диенов
- •3.3.2 Химические особенности 1,3-алкадиенов
- •3.4. Алкины: определение, изомерия, номенклатура
- •3.4.1. Способы получения.
- •3.4.2. Химические свойства
- •Глава 4 карбоциклические соединения
- •4.1. Алициклический ряд: определение, изомерия, номенклатура
- •4.1.1 Способы получения
- •4.1.2. Химические свойства
- •4.1.3. Современные представления о строении моноциклоалканов.
- •4.2. Ароматические углеводороды
- •4.2.1. Строение бензола
- •4.2.2. Способы получения
- •4.2.3. Химические свойства
- •4.3.4. Правила ориентации в бензольном кольце
- •4.2.5. Механизм ориентирующего влияния заместителей
- •4.3. Многоядерные ароматические соединения с неконденсированными и конденсированными бензольными ядрами
- •4.3.1. Основные способы получения
- •4.3.2. Химические особенности
- •Функциональные производные углеводородов
- •Глава 5 галогенопроизводные
- •5.1. Галогенопроизводные: определение, изомерия, номенклатура
- •5.2. Способы получения
- •5..3 Химические свойства
- •Глава 6 кислородсодержащие органические соединения
- •6.1. Спирты: определение, изомерия, номенклатура
- •6.1.1. Способы получения
- •6.1.2 Физические свойства спиртов
- •6.1.3. Химические свойства
- •6.1.4 Понятие о непредельных и многоатомных спиртах
- •6.2. Фенолы: определение, изомерия, номенклатура
- •16.2.1. Способы получения
- •6.2.2. Химические свойства
- •6.3. Простые эфиры: определение, изомерия, номенклатура
- •6.3.1. Способы получения
- •6.3.2. Химические свойства
- •6.3.3. Окись этилена (эпоксисоединения)
- •6.4. Оксосоединения (альдегиды и кетоны)
- •6.4.1. Определение, изомерия и номенклатура оксосоединений
- •6.4.2. Способы получения
- •6.4.3. Химические свойства
- •6.4.4. Понятие о непредельных альдегидах и кетонах
- •6.4.5. Особенности получения и химические свойства хинонов
- •Задачи для самопроверки
- •6.5. Одно и многоосновные карбоновые кислоты и их производные: определение, изомерия, номенклатура
- •6.5.1. Способы получения
- •6.5.2. Химические свойства
- •6.5.3. Особенности предельных и непредельных кислот
- •Задачи для самопроверки
- •Глава 7. Серосодержащие соединения
- •7.1. Органические соединения двухвалентной серы (Тиолы, сульфиды, дисульфиды)
- •7.2. Сульфиновые кислоты и их производные
- •7.3. Сульфоновые кислоты и их производные. Сульфоны.
- •Глава 8. Азотсодержащие органические соединения
- •8.1 Нитросоединения: определение, изомерия, номенклатура.
- •8.1.1. Способы получения
- •8.1.2. Химические свойства
- •Задачи для самопроверки
- •8.2 Амины: определение, изомерия, номенклатура
- •8.2.1 Способы получения
- •8.2.2. Химические свойства
- •8.2.3. Понятие о диаминах
- •Задачи для самопроверки
- •8.3. Диазо- и азосоединения: определение, изомерия, номенклатура
- •8.3.1. Способы получения
- •8.3.2 Физические и химические свойства
- •II. Реакции без выделения азота
- •Задачи для самопроверки
- •Глава 9 . Гетерофункциональные соединеия
- •9.1. Гидроксикислоты: определение, изомерия, номенклатура
- •9.1.1. Способы получения
- •9.1.2. Химические свойства
- •9.1.3. Оптическая изомерия гидроксикислот
- •9.1.4. Ароматические гидроксикислоты и их производные
- •Задачи для самопроверки
- •9.2. Альдегидо- и кетокислоты: определение, изомерия, номенклатура
- •9.2.1. Способы получения
- •9.2.2. Химические особенности
- •9.2.3. Применение ацетоуксусного эфира в органическом синтезе
- •Задачи для самопроверки
- •9.3. Аминокислоты: определение, изомерия, номенклатура
- •9.3.1. Способы получения
- •9.3.2. Химические свойства
- •Задачи для самопроверки
- •Глава 10. Гетероциклические соединения
- •10.1. Определение и классификация гетероциклических соединений.
- •10.2. Пятичленные гетероциклические соединения: изомерия, номенклатура, ароматический характер.
- •10.2.1. Способы получения пятичленных гетероциклических соединений.
- •10.2.3. Химические свойства
- •10.3. Понятие о конденсированных гетероциклах (индол)
- •10.4. Шестичленные гетероциклические соединения: изомерия, номенклатура
- •10.4.1. Химические свойства.
- •Глава 11. Липиды
- •11.1.Определение, классификация изомерия, номенклатура
- •11.2. Простые липиды. (Жиры, масла)
- •10.3. Сложные липиды. Понятие о фосфолипидах.
- •10.4. Понятие о циклических липидах
- •Глава 12. Углеводы
- •12.1. Определение, классификация, изомерия, номенклатура.
- •12.2. Моносахариды: строение, оптическая изомерия.
- •12.3.Химические свойства моносахаридов.
- •12.4. Олигосахариды: особенности строения, химические свойства
- •12.5. Несахароподобные полисахариды: крахмал, гликоген, клетчатка.
- •Глава 13. Пептиды и белки
- •13.1. Протеиногенные аминокислоты
- •13.2. Понятие о строении пептидов.
- •13.3. Особенности строения белков
- •Глава 14. Нуклеиновые кислоты
- •14.1. Понятие о составе и строении нуклеиновых кислот
- •14.2. Классификация и биологическая роль нуклеиновых кислот
16.2.1. Способы получения
1) Значительные количества фенола получают сплавлением натриевой соли бензолсульфокислоты со щелочами (реакция нуклеофильного замещения)

2) Гидролиз галогенопроизводных (реакция Ульмана). В технике получают фенол с хорошим выходом из хлорбензола
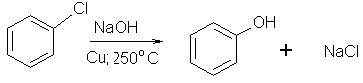
3) Разложение гидропероксидов. В промышленности фенол совместно с ацетоном получают при разложении гидроперекиси кумола

4) Окислительное декарбоксилирование карбоновых кислот. Реакция протекает в присутствии солей меди(II) при температуре 200–3000С. В реактор пропускают водяной пар и воздух:
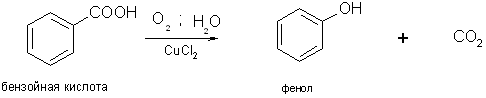
5) Разложение солей диазония в присутствии раствора серной кислоты:
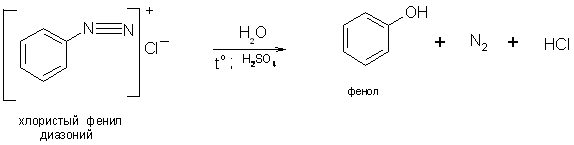
Физические свойства
Фенолы – обычно кристаллические вещества, трудно растворимые в воде. Летучи с парами воды. Обладают характерным запахом. Являются антисептиками, очень ядовиты. При попадании на кожу вызывают ожоги. С водой образуют кристаллогидраты с более низкой температурой плавления, чем исходный фенол.
Двух- и трехатомные фенолы – кристаллические вещества, легко растворимые в воде.
6.2.2. Химические свойства
По своему строению фенолы аналогичны спиртам. Однако гидроксильная группа и непосредственно связанное с ней бензольное кольцо оказывают сильное влияние друг на друга, что обуславливает специфичность свойств фенолов.
1) Кислые свойства фенолов более ярко выражены, чем у спиртов. Это объясняется тем, что свободная электронная пара атома кислорода в феноле оттянута к ядру (+М–эффект).


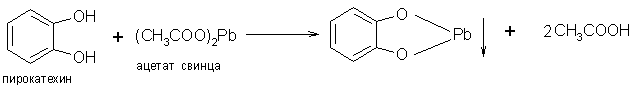
Многоатомные фенолы обнаруживают еще более сильные кислые свойства, чем фенол. Например, для пирокатехина характерно выпадение нерастворимой свинцовой соли при его прибавлении к раствору ацетата свинца:
Феноляты железа имеют комплексный характер. Их растворы интенсивно окрашены. Эта реакция используется для качественного открытия фенолятов. Фенол дает с раствором FeCl3 фиолетовую окраску, крезолы – голубую, пирокатехин – зеленую.
2) Фенолы способны образовывать простые и сложные эфиры. При действии на феноляты галогеналкилов, галогенангидридов и ангидридов кислот:


3) Гидроксильная группа оказывает очень большое влияние на ароматическое кольцо, увеличивая его реакционную способность в о- и п- положениях, поэтому фенол очень легко вступает во всевозможные реакции электрофильного замещения и конденсации:

Реакция конденсации с алифатическими альдегидами имеет большое практическое значение, так как лежит в основе производства пластических масс и лаковых основ.
4) При гидрировании водородом в присутствии катализаторов фенолы превращаются в спирты ряда циклогексана:

5) Вступление гидроксильной группы в ядро делает его менее устойчивым к действию окислителей. Наиболее легко окисляются моногоатомные фенолы, содержащие гидроксильные группы в о- и п- положениях:

6) Из всех фенолов флороглюцин наиболее склонен к таутометрии. Например с гидроксиламином он дает триоксим.

6.3. Простые эфиры: определение, изомерия, номенклатура
Замещая в молекуле спирта или фенола атом водорода гидроксильной группы на какой либо радикал, получают эфиры.
Номенклатура и изомерия простых эфиров
Согласно номенклатуре ИЮПАК, простые эфиры называют прибавляя к названию наиболее длинного углеводородного радикала в качестве приставки название алкоксигруппы (R–O) или для эфиров фенолов – арилоксигруппы (Ar–O).
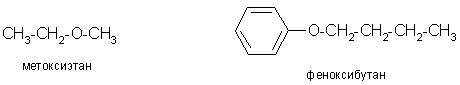
Простые эфиры называют также, используя название радикалов и слово эфир. Кроме того, используются тривиальные название.

Помимо обычной изомерии, обусловленной строением углеводородных радикалов, например

у этих эфиров имеется еще один вид изомерии, называемой метамерией. Так диэтиловый эфир и метилпропиловый эфир являются метамерами.
![]()
Простые эфиры изомерны спиртам.
