
- •1)Свет. Интерференция света.
- •2)Расчет интерференционной картины от двух источников
- •3)Полосы равного наклона
- •4)Кольца Ньютона
- •5) Принцип гюйгенса - френеля
- •6) Дифракция френеля на круглом отверстии и диске
- •8) Дифракционная решетка
- •9)Поляризация света. Закон Малюса. Вращение плоскости поляризации.
- •10)Способы получения поляризованного света. Закон Брюстера. Двойно́е лучепреломле́ние
- •12) Рассеяние света. Зако́н Ламберта.
- •13) Теплово́е излуче́ние и его характеристики. Закон Больцмана.
- •Закон Стефана—Больцмана
- •14) Закон излучения Кирхгофа. Вина закон смещения
- •16) Рентге́новское излуче́ние. Рентгеновская трубка
- •17) Законы фотоэффекта.
- •18) Эффект Комптона. Давление света
- •19) Гипотеза де Бройля
- •20) Соотношение неопределенности Гейзенберга
- •22) Квантование энергии электрона в атоме
- •23) Модель строения атома по Резерфорду.
- •24) Опыт Франка — Герца
- •26) Квантовая механическая задача об атоме водорода Решение уравнения Шрёдингера. Краткий обзор результатов
- •27) Квантовые числа и их физический смысл
- •28) Строение ядра. Характеристики атомного ядра. Размеры ядер
- •30) Ядерные взаимодействия
- •Взаимодействие нуклонов в атомном ядре
- •32) Альфа-распад, бета-минус-распад, бета-плюс-распад, к-захват Альфа-распад
- •Бета-распад
- •Гамма-распад (изомерный переход)
27) Квантовые числа и их физический смысл
Главное квантовое число n характеризует энергию электронной орбитали. Главное квантовое число принимает значения 1, 2, 3, 4, 5, 6, 7…∞, обозначаемые также буквами K, L, M, N , O, P, Q … Чем больше n, тем выше энергия орбитали. Переходы электронов с одной орбитали на другую сопровождается излучением или поглощением квантов энергии.
Главное квантовое число характеризует также удаленность максимума электронной плотности от ядра. Чем больше n, тем больше объем орбитали. Совокупность электронов с одинаковым значением n называют энергетическим уровнем или оболочкой, слоем.
Орбитальное (побочное, азимутальное) квантовое число l принимает значения от 0 до (n-1) и характеризует форму граничной поверхности атомной орбитали. Обозначения: 0-s; 1-p; 2-d; 3-f и т.д. Совокупность электронов, имеющих одинаковые значения l и n, называют энергетическим подуровнем (подоболочкой). Граничная поверхность s-орбиталей имеет форму сферы (рис.4.1,а), р-орбиталей – гантели (рис.4.1,b-d). Граничные поверхности d-орбиталей показаны на рис.4.1,e-i. Форма граничных поверхностей f-орбиталей сложнее, чем d-орбиталей.
Орбитальное квантовое число характеризует также энергию электронов подуровня в пределах данного энергетического уровня.
Энергия подуровней возрастает в ряду s,p,d,f (Es<Ep<Ed<Ef).
Магнитное квантовое число ml характеризует ориентацию орбитали в пространстве и может принимать целочисленные значения от +l до –l, включая 0. d-подуровень содержит пять орбиталей, s-подуровень – одну (рис.4.1,a), p-подуровень – три (рис.4.1,b-d), а f-подуровень – семь орбиталей.
Атомной орбиталью называют также волновую функцию, характеризуемую определенным набором трех квантовых чисел
Спиновое квантовое число ms характеризует собственное вращение электрона вокруг своей оси и может принимать два значения - +1/2 и -1/2.
Состояние электрона в атоме полностью характеризуется с помощью четырех квантовых чисел n, l, ml
28) Строение ядра. Характеристики атомного ядра. Размеры ядер
А́томное ядро́ — центральная часть атома, в которой сосредоточена основная его масса (более 99,9 %). Ядро заряжено положительно, заряд ядра определяет химический элемент, к которому относят атом. Размеры ядер различных атомов составляют несколько фемтометров, что в более чем в 10 тысяч раз меньше размеров самого атома.
Атомное
ядро состоит
из нуклонов —
положительно заряженных протонов и
нейтральных нейтронов,
которые связаны между собой при
помощисильного
взаимодействия.
Протон и нейтрон обладают собственным
моментом количества движения (спином),
равным ![]() [сн
1] и
связанным с ним магнитным
моментом.
[сн
1] и
связанным с ним магнитным
моментом.
Ядром называется центральная часть атома, в которой сосредоточена практически вся масса атома и его положительный электрический заряд. Все атомные ядра состоят из элементарных частиц: протонов и нейтронов, которые считаются двумя зарядовыми состояниями одной частицы - нуклона. Протон имеет положительный электрический заряд, равный по абсолютной величине заряду электрона. Нейтрон не имеет электрического заряда.
2. Зарядом ядра называется величина Ze, где е - величина заряда протона, Z - порядковый номер химического элемента в периодической системе Менделеева, равный числу протонов в ядре. В настоящее время известны ядра с Z от Z=1 до Z=107. Для всех ядер, кроме и некоторых других нейтронодефицитных ядер NіZ, где N - число нейтронов в ядре. Для легких ядер N/Z»1; для ядер химических элементов, расположенных в конце периодической системы, N/Z»1,6.
3. Число нуклонов в ядре A=N+Z называется массовым числом. Нуклонам (протону и нейтрону) приписывается массовое число, равное единице, электрону - нулевое значение А.
Ядра с одинаковыми Z, но различными А называются изотопами. Ядра, которые при одинаковом А имеют различные Z, называются изобарами. Ядро химического элемента X обозначается , где Х - символ химического элемента.
Всего известно около 300 устойчивых изотопов химических элементов и более 2000 естественных и искусственно полученных радиоактивных изотопов.
4. Размер ядра характеризуется радиусом ядра, имеющим условный смысл ввиду размытости границы ядра. Эмпирическая формула для радиуса ядра м, может быть истолкована как пропорциональность объема ядра числу нуклонов в нем.
Плотность ядерного вещества составляет по порядку величины 1017 кг/м3 и постоянна для всех ядер. Она значительно превосходит плотности самых плотных обычных веществ.
5. Ядерные частицы имеют собственные магнитные моменты, которыми определяется магнитный момент ядра Рm яд в целом. Единицей измерения магнитных моментов ядер служит ядерный магнетон m яд: (в СИ), (в СГС).
Здесь е - абсолютная величина заряда электрона, mp - масса протона, с - электродинамическая постоянная. Ядерный магнетон в раз меньше магнетона Бора, откуда следует, что магнитные свойства атомов определяются магнитными свойствами его электронов.
6. Распределение электрического заряда протонов по ядру в общем случае несимметрично. Мерой отклонения этого распределения от сферически симметричного является квадрупольный электрический момент ядра Q. Если плотность заряда считается везде одинаковой, то Q определяется только формой ядра.
29) Дефе́кт ма́ссы. Энергия связи. Ядерные силы
Д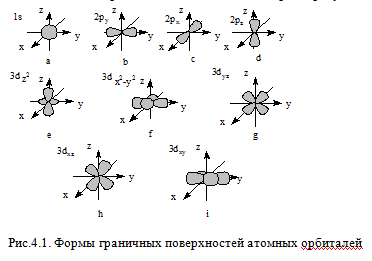 ефе́кт
ма́ссы.
В связи с различием в советской и
зарубежной номенклатуре понятие дефекта
масс не является однозначно определенным.
ефе́кт
ма́ссы.
В связи с различием в советской и
зарубежной номенклатуре понятие дефекта
масс не является однозначно определенным.
Советская номенклатура:
Дефе́кт ма́ссы — разность между массой покоя атомного ядра данного изотопа, выраженной в атомных единицах массы, и массовым числом данного изотопа. В современной науке для обозначения этой разницы пользуются термином избыток массы (англ. mass excess). Как правило, избыток массы выражается в кэВ.
![]()
Зарубежная номенклатура:
Дефе́кт
ма́ссы (англ. mass
defect)
— разность между суммой масс
покоя нуклонов,
составляющих ядро данного нуклида,
и массой
покоя атомного
ядра этого
нуклида, выраженная в атомных
единицах массы.
Обозначается обычно ![]() .
.
![]()
Согласно соотношению Эйнштейна, энергия связи пропорциональна дефекту массы:
![]()
где — дефект массы и с — скорость света в вакууме.
Дефект массы характеризует устойчивость ядра.
Дефект массы, отнесённый к одному нуклону, называется упаковочным множителем.
Энергия связи (для данного состояния системы) — разность между полной энергией связанного состояния системы тел или частиц и энергией состояния, в котором эти тела или частицы бесконечно удалены друг от друга и находятся в состоянии покоя:
![]()
где ![]() —
энергия связи компонентов в системе
из i компонент (частиц),
—
энергия связи компонентов в системе
из i компонент (частиц), ![]() —
полная энергия i-го компонента в
несвязанном состоянии (бесконечно
удалённой покоящейся частицы) и
—
полная энергия i-го компонента в
несвязанном состоянии (бесконечно
удалённой покоящейся частицы) и ![]() —
полная энергия связанной системы.
—
полная энергия связанной системы.
Для системы, состоящей из бесконечно удалённых покоящихся частиц энергию связи принято считать равной нулю, т.е. при образовании связанного состояния энергия выделяется. Энергия связи равна минимальной работе, которую необходимо затратить, чтобы разложить систему на составляющие её частицы и характеризует стабильность системы: чем выше энергия связи, тем система стабильнее.
Для валентных электронов (электронов внешних электронных оболочек) нейтральных атомов в основном состоянии энергия связи совпадает с энергией ионизации, для отрицательных ионов - со сродством к электрону.
Энергии химической связи двухатомной молекулы соответствует энергия её термической диссоциации составляет порядка сотен кДж/моль.
Энергия связи адронов атомного ядра определяется сильным взаимодействием. Для легких ядер она составляет ~0.8 МЭв на нуклон.
Ядерные силы силы — удерживающие нуклоны (протоны и нейтроны) в ядре. Они действуют только на расстояниях не более 10 -13 см и достигают величины, в 100-1000 раз превышающей силу взаимодействия электрических зарядов.
Ядерные силы не зависят от заряда нуклонов. Они обусловлены сильным взаимодействием.
