
- •Общая хар.И хим.Св-ва щел Ме.
- •Особенности химии Li.
- •Гидриды,оксиды,пероксиды,гидрокиды щМе:хим.Связь в соединении и получение.
- •Получение Na,NaOh,Na2co3 в промыш.
- •Общая характеристика солей Be,Mg и щел.-зем. Металлов,их растворимость,гидролиз.
- •Оксид,гироксид,соли Al: их получение с св-ва
- •Оксиды углерода(II,IV):промышленное получение и в лаоратории,кислотно-основные и ов св-ва.Карбонилы металлов.
- •Оксиды и гироксиды Sn,Pb.Взаимодействие с к-ми и щелочами,ов св-ва.
- •Аммиак и гидрозин:получение,хим.Связь,строение полекулы,к-о,ов.
- •Гироксиламмин,азотистоводоодная к-та и её соли:хим.Связь,строение полекулы,получение и в-ва.
- •Фосфорноватистая и фосфорная к-ты:получение,строение молкулы,к-о св-ва,ов.Фосфиты,гипофосфиты.
- •Окиды фотфора:получение,строение молекулы,св-ва.
- •Получение и св-ва сероводорода.Растворимость и гидролиз сульфидов.Отношение сульфидов к кислотам.
- •Кислородосодержащие к-ты серы,селена и теллура:получение,к-о св-ва,ов св-ва.
- •Общая характеристика и св-ва меди,серебра,золота.
- •Общая характеристика и св-ва подгруппы Zn.
- •Общая характеристика и св-ва Cr,Mo,w.
- •Общая харктеристика и св-ва Mn,Tc,Re.
- •Маргонцевая к-та и её ангидлрид.
- •Диоксид марганца,манганаты,перманганаты.
- •Гидролиз солей по катиону,но аниону,совместнй гидролиз.
- •Химические свойства
- •Ассоциация молекул фтороводорода.Дифторид калия.
- •Оксиды Cl2,i2:получение и св-ва.
- •Галогенангидриды:получение и гидролиз.
Фосфорноватистая и фосфорная к-ты:получение,строение молкулы,к-о св-ва,ов.Фосфиты,гипофосфиты.
Получение:
1)Фосфорноватистую кислоту получают в две стадии. На первой стадии белый фосфор обрабатывается растовором щелочи:
2Р4(белый) + 3Ва(ОН)2 + 6H2O → 2PH3 + 3Ва(Н2PO2)2
И затем выделяют кислоту, обрабатывая ее соль более сильной кислотой (серной):
Ва(Н2PO2)2 + H2SO4 → BaSO4↓ + 2H3PO2
2)Ca3(PO4)2+3H2SO4=3CaSO4↓+2H3PO4
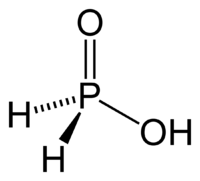
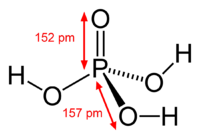
Фосфорноватистая и гипофосфиты в-ли.,легко окисляются до фосфорной к-ты и её солей. сильная одноосновная кислота
3H3PO2=PH3+2H3PO3(t)
H3PO4-не ядовита.При обычных условичх реогрирует с гироксиддами и карбонатами.
H3PO4 — трехосновная кислота средней силы. При взаимодействии с очень сильной кислотой, например HClO4, фосфорная кислота проявляет признаки амфотерности — образуются соли фосфорила, например [Р(ОН)4]·(ClO4).
Отличительной реакцией ортофосфорной кислоты от других фосфорных кислот является реакция с нитратом серебра — образуется жёлтый осадок:
Н3РО4 + 3AgNO3 = Ag3PO4 + 3HNO3
Качественной реакцией на ион РО43− является образование ярко-жёлтого осадка молибденофосфата аммония:
H3PO4 + 12(NH4)2MoO4 + 21HNO3 = (NH4)3PMo12O40·6H2O + 21NH4NO3 + 6Н2О
Фосфиты — соли фосфористой кислоты Н3РО3.
Окиды фотфора:получение,строение молекулы,св-ва.
Получение:
1)Обратное диспропорционирование оксида фосфора(V) и белого фосфора:
![]()
Оксид фосфора(V) получают сжиганием фосфора. Технологический процесс происходит в камере сжигания и включает в себя окисление элементарного P предварительно осушенным воздухом, осаждение P4O10 и очистку отходящих газов. Очищают полученный пентаоксид возгонкой.4P + 5O2 → 2P2O5 + 2984 кДж.
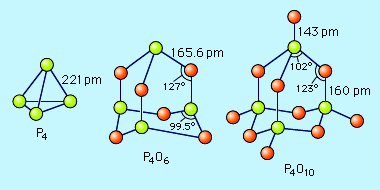
P4O10 очень активно взаимодействует с водой, образуя смеси фосфорных кислот, состав которых зависит от количества воды и других условий:
P4O10 + 6H2O (ж) → 4H3PO4 (-177 кДж)
способен извлекать воду из других соединений:
2HNO3 + P2O5 → 2HPO3 + N2O5;
4HClO4 + P4O10 → (НРО3)4 + 2Cl2O7.
Он реагирует с амидами, превращая их в нитрилы:
P4O10 + RC(O)NH2 → P4O9(OH)2 + RCN
Карбоновые кислоты переводит в соответствующие ангидриды:
P4O10 + 12RCOOH → 4H3PO4 + 6(RCO)2O
или
P2O5 + 6RCOOH → 2H3PO4 + 3(RCO)2O
Также взаимодействует со спиртами, эфирами, фенолами и другими органическими соединениями.Реагирует с NH3 и с галогеноводородами, образуя фосфаты аммония и оксигалогениды фосфора:
P4O10 + 8PCl3 + O2 → 12Cl3PO
1)
![]()
2) с холодной![]()
с горячей.
![]()
3)
![]()
4)
![]()
5)
![]()
6)
![]()
Кислоты фосфора(+5) кач.р-ция на них,получение фофорной к-ты в промышлен.
1)Ca3(PO4)2+3H2SO4=3CaSO4↓+2H3PO4.
Кач.реакции:не свертывают яичный белок.
H3PO4+3AgNO3=Ag3PO4(осадок)+3HNO3
H4P2O7(разб.) + 4AgNO3 = Ag4P2O7↓(бел.) +
4HNO3
Общая рарактеристика и св-ва мышьяка,сурьмы,висмута.
Существуют в нескольких аллотропных модификациях.При комнатной температуре р-ют только с галогенами,при нагревании на воздухе они скорают с образованием оксидов Э2О3,а расплавленной серой дают Э2S3,с металлами образуют сплавы.Кислоты-окислители окисляют мышьяк и сурьму до мышьяковой и сурьмяной к-т:
3As+5HNO3+2H2O=3H3AsO4+5NO;
3Sb+5HNO3=5NO+H2O+3HSbO3.
Bi в конц.к-те пассивируется,но в разбавленной:
Bi+4HNO3=Bi(NO3)3+NO+2H2O
Металличекие сурьма и висмут,могут реагировать с HCl(k) в присутствии о-ля:
2Sb+12HCl+3H2O=2H3[SbCl6]+6H2O
Сульфиды мышьяка,сурьмы,висмута:их отношение к к-там и к раствору сульфида аммония.
1)Sb2S3+12HCl(k)=2H3[SbCl6]+3H2S
Sb2S5+12HCl(k)=2H3[Sbl6]+3H2S+2S↓
Sb2S3 + (NH4)2S= (NH4)3SbS3
2) 3(NH4)2S + As2S3 = 2(NH4)3AsS3
(NH4)2S + As2S5 = 2 (NH4)3AsS4
As2S5 + 15H2SO4(конц., гор) = 2H3AsO4 + 20SO2 + 12H2O
As2S3 + 9H2SO4(конц.) = As2O3↓ + 12SO2 + 9H2O
3)Bi2S3+12HCl=2H3[BiCl6]+3H2S
3 Bi2S3+8HNO3=2Bi(NO3)3+2NO+9S+4H2O
Галогениды сурьмы,мышьяка и висмута:получение и гитролиз.Тиосоли и Тиокислоты.
Получение:Тригалогениды получают взаимодействием простых в-в с умеренным к-вом галогена:2Sb+3Cl2=2SbCl3
Или кипячением оксидов конц.галоген.водород.к-т:
As2O3+6HCl↔2AsCl3+3H2O
Пентагалогениды синтезируютс действием избытка галогена на тригалогениды:BiF3+F2=BiF5 или
Sb2O5+10HCl=2SbCl5+5H2O.
Гидролиз:
AsCl3+3H2O=H3AsO3+3HCl
Получение кислорода и пероксида водорода в промышленности и в лаборатории.
В лаборатории:
2KMnO4 → K2MnO4 + MnO2 + O2↑
2KClO3 → 2KCl + 3O2↑.
Практически значима р-ция:
2СО2+2Na2O2=2Na2CO3+O2
Пероксид водорода получают в промышленности при реакции с участием органических веществ, в частности, каталитическим окислением изопропилового спирта:
(CH3)2СН(ОН) + O2 → CH3C(O)CH3 + H2O2
В лабораторных условиях для получения пероксида водорода используют реакцию:
BaO2 + H2SO4 → H2O2 + BaSO4
Общая характеристика и хим.св-ва серы,селена,теллура.
Для S,Se,Te,Po используют общее название-халькогены. S,Se,Te-неметаллы,р-элементы.Из шести эл-нов внешнего слоя атомов два неспаренные,что определяет валентность II,в возбужденном состоянии 4 и 6.Имеют высокое значение электроотрицательности,могут проявлять СО(-2),(-1),(0).Потенциалы ионизации не велики,в соединении с галогенами и кислородом (+4) и (+6).
В соединениях S,Se,Te много общего.По группе ↓ увеличение кислотных и восстановительных св-в в ряду соединений с водородом Н2Э;увеличение ок-ных св-в в ряду однотипных соединений;уменьшение термической устойчивости халькогенводородов и солей кислородных к-т.
S+6HNO3(k)=6NO2+H2SO4+2H2O
S+2H2SO4(k)=3SO2+2H2O
3S+6NaOH=2Na2S+Na2SO3+3H2O
3Se+6NaOH(k)=2Na2Se+Na2SeO3+3H2O
3Se+4HNO3+H2O=3H2SeO3+4NO
2Te+9HNO3=Te2O3(OH)NO3+8NO2+4H2O
