
- •Общая хар.И хим.Св-ва щел Ме.
- •Особенности химии Li.
- •Гидриды,оксиды,пероксиды,гидрокиды щМе:хим.Связь в соединении и получение.
- •Получение Na,NaOh,Na2co3 в промыш.
- •Общая характеристика солей Be,Mg и щел.-зем. Металлов,их растворимость,гидролиз.
- •Оксид,гироксид,соли Al: их получение с св-ва
- •Оксиды углерода(II,IV):промышленное получение и в лаоратории,кислотно-основные и ов св-ва.Карбонилы металлов.
- •Оксиды и гироксиды Sn,Pb.Взаимодействие с к-ми и щелочами,ов св-ва.
- •Аммиак и гидрозин:получение,хим.Связь,строение полекулы,к-о,ов.
- •Гироксиламмин,азотистоводоодная к-та и её соли:хим.Связь,строение полекулы,получение и в-ва.
- •Фосфорноватистая и фосфорная к-ты:получение,строение молкулы,к-о св-ва,ов.Фосфиты,гипофосфиты.
- •Окиды фотфора:получение,строение молекулы,св-ва.
- •Получение и св-ва сероводорода.Растворимость и гидролиз сульфидов.Отношение сульфидов к кислотам.
- •Кислородосодержащие к-ты серы,селена и теллура:получение,к-о св-ва,ов св-ва.
- •Общая характеристика и св-ва меди,серебра,золота.
- •Общая характеристика и св-ва подгруппы Zn.
- •Общая характеристика и св-ва Cr,Mo,w.
- •Общая харктеристика и св-ва Mn,Tc,Re.
- •Маргонцевая к-та и её ангидлрид.
- •Диоксид марганца,манганаты,перманганаты.
- •Гидролиз солей по катиону,но аниону,совместнй гидролиз.
- •Химические свойства
- •Ассоциация молекул фтороводорода.Дифторид калия.
- •Оксиды Cl2,i2:получение и св-ва.
- •Галогенангидриды:получение и гидролиз.
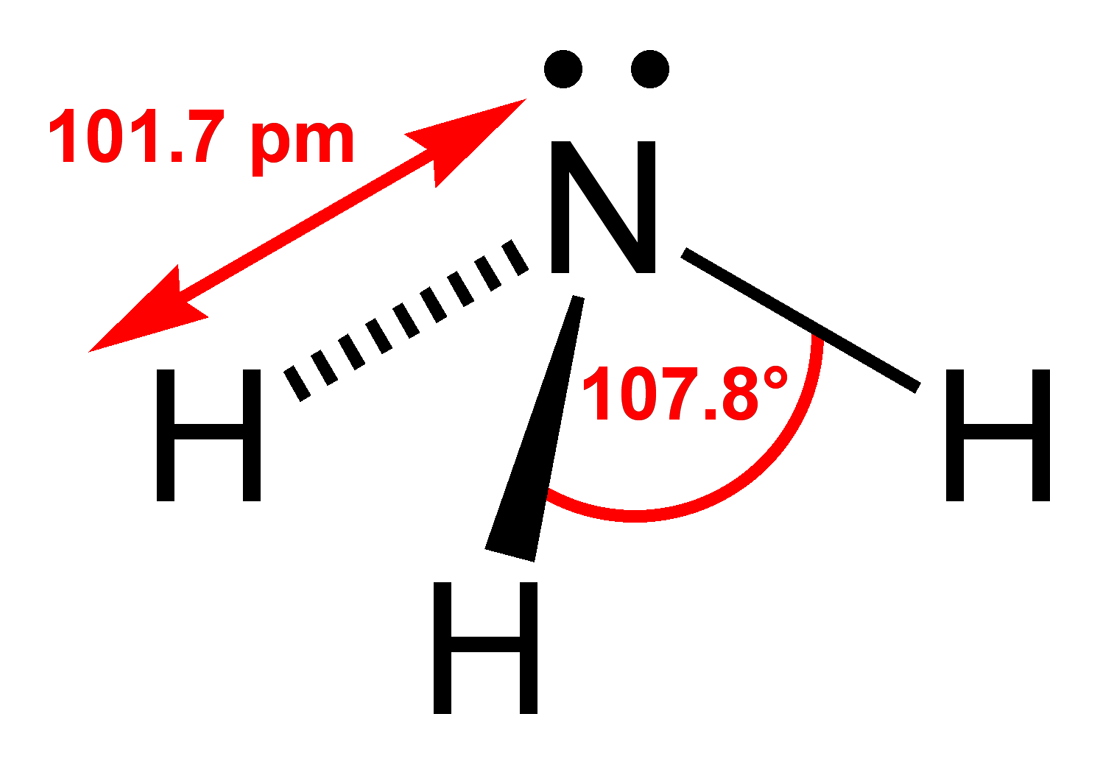
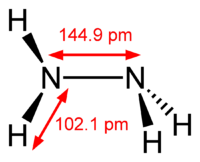
Аммиак и гидрозин:получение,хим.Связь,строение полекулы,к-о,ов.
Получение:
NH3 +
NaClO ![]() NH2Cl
+ NaOH
NH2Cl
+ NaOH
NH2Cl + NH3 N2H4 · HCl,(гидразин)
N2(г) + 3H2(г) ↔ 2NH3(г) + 91,84 кДж
Аммиак и гидразин проявляют восстановительные св-ва и ок-ются чаще всего до азота:
4NH3+3O2=2N2+6H2O
N2H4+O2=N2+2H2O
Три неспаренных p-электрона атома азотаучаствуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать донорно-акцепторную связь с ионом водорода, образуя ион аммония NH4+. В жидком аммиаке молекулы связаны между собой водородными связями. во многих реакциях аммиак выступает как основание Бренстеда. Гидразин — энергичный восстановитель. В растворах гидразин обычно также окисляется до азота:4KMnO4 + 5N2H4 + 6 H2SO4 → 5N2 + 4MnSO4 + 2K2SO4 + 16H2O. Водные растворы гидразина обладают основными свойствами
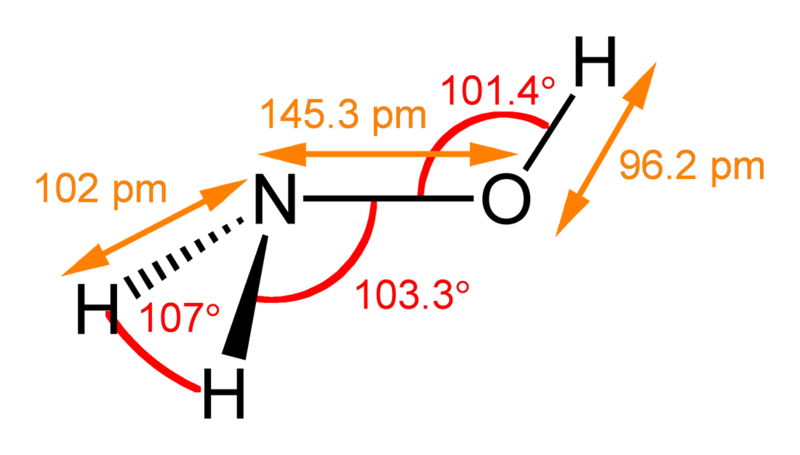
Гироксиламмин,азотистоводоодная к-та и её соли:хим.Связь,строение полекулы,получение и в-ва.
![]()
NH3OH:Получают электрохимическим вос-ем р-ра азотной к-ты на свинцовом катоде:
NO3(-)+6e+8H(+)=NH3OH(+)+2H2O
Образовавщийся ион осаждают HCl виде [NH3OH]Cl,далее:
[NH3OH]Cl+NaOH=NH2OH+NaCl+H2O
1)В водном растворе диссоциирует по основному типу, являясь слабым основанием:
NH2OH + H2O ↔ NH3OH+ + OH−
Может также диссоциировать и по кислотному типа с рКа = 14,02:
NH2OH + H2O ↔ H3O+ + NH2O−
В кислом водном растворе гидроксиламин устойчив, однако ионы переходных металлов катализируют его распад. Подобно NH3, реагирует с кислотами, образуя соли гидроксиламиния, например:
NH2OH + HCl → [NH3OH]Cl
2)На воздухе соединение является нестабильным:
3NH2OH → N2 + NH3 + 3H2O
3)На воздухе легко окисляется кислородом воздуха:
4NH2OH + O2 = 6H2O + 2N2
4)Гидроксиламин проявляет свойства восстановителя, при действии на него окислителей выделяются N2 или N2O:
2NH2OH +I2 + 2КОН → N2 + 2KI + 4H2O
5)В некоторых реакциях NH2OH проявляются окислительные свойства, при этом он восстанавливается до NH3 или NH4+, например:
NH2OH + H2S → NH3 + S + H2O
Получение:
2NaNH2 + N2O → NaN3 + NaOH + NH3
3NaN3 + H3PO4 → 3HN3 + Na3PO4
Проявл.ок-ные св-ва и вос. По схеме:
HN3+3H(+)+2e=N2+NH4(+) реже
HN3+11H(+)+8e=3NH4(+)
Св-ва объясняются:
H-N=N=N(у азота СО -3;+5;-3)
Р-ет металлы стоящие после водорода 4HN3+Cu=Cu(N3)2+N2+(NH4)N3
Pt+2HN3+8HCl=H2[PtCl6]+2N2+2NH4Cl
Подобно царской водке.
Соли называются азидами.Соли щ.мет. устойчивы,напоминают галогениды.Азиды тяж.мет.не устойчивы,при ударе взрыв.
Получить можно:
N2H4+HNO2=2H2O+HN3
Царская водка и её ок-ны св-ва на
примере р-ции с золотом,платиной,сульфидом ртути.
Представляет собой жидкость жёлто-оранжевого цвета с сильным запахом хлора и диоксида азота.
При взаимодействии HCl и HNO3 образуется сложная смесь высокоактивных продуктов, в том числе ассоциатов и свободных радикалов. Эффективность царской водки как окислителя в значительной степени связана с уменьшением потенциала окисления металлов вследствие образования хлоридных комплексных соединений.
Один из сильнейших ок-лей.
![]()
3Pt+4HNO3+18HCl=3H2[PtCl6]+4NO↑+8H2O
3HgS+8HNO3+6HCl=3HgCl2+3H2SO4+8NO+4H2O
Реакции термического разложния нитратов различных металлов.
Ковалентные металлы[Ti(IV),Sn(IV) и др.]в водной среде:Sn(NO3)4+3H2O=H2SnO3↓+4HNO3
Нитраты Me в ряду напряжений от Mg до Cu:
2Mg(NO3)2=2MgO+4NO2+O2
Термически неустойчивые нитраты(Hg,Ag,Au):
Hg(NO3)2=Hg+2NO2+O2
Общая характеристика и св-ва фосфора,промышленное получение.
Один из распространённых элементов земной коры: его содержание составляет 0,08—0,09 % её массы. В свободном состоянии не встречается из-за высокой химической активности. Образует около 190 минералов, важнейшими из которых являются апатит Ca5(PO4)3(F,Cl,OH), фосфорит и другие. Фосфор содержится во всех частях зелёных растений, ещё больше его в плодах и семенах. Содержится в животных тканях, входит в состав белков и других важнейших органических соединений (АТФ, ДНК), является элементом жизни.Существует в виде нескольких аллотромных модификаций,важнейшие:белый,красный и черный.
1)реагирует с гал. При обычных усл:
2P+5Cl2=2PCl5
При нагревании ок-ется серой:
4P+3S=P4S3
2)с кислотами-окислителями:
3P+5HNO3+2H2O=3H3PO4+5NO
3)р-ры сильных окислитей взаимодействуют со всеми модификациями:
3P4+20KMnO4+8H2O=20MnO2+8K2HPO4+
4KH2PO4
4)c Me способен быть ок-лем:
2P+3Ca=Ca3P2(t)
5) Фосфор легко окисляется кислородом:
4P + 5O2 → 2P2O5 (с избытком кислорода),
4P + 3O2 → 2P2O3 (при медленном окислении или при недостатке кислорода).
6) 8Р + 12Н2О = 5РН3 + 3Н3РО4 (фосфорная кислота).
7) 4Р + 3KOH + 3Н2О → РН3 + 3KН2РО2.
Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и кремнезёмом при температуре 1600 °С:
2Ca3(PO4)2 + 10C + 6SiO2 → P4 + 10CO + 6CaSiO3.
Образующиеся пары белого фосфора конденсируются в приёмнике под водой. Вместо фосфоритов восстановлению можно подвергнуть и другие соединения, например, метафосфорную кислоту:
4HPO3 + 12C → P4 + 2H2 + 12CO.
