
- •Общая хар.И хим.Св-ва щел Ме.
- •Особенности химии Li.
- •Гидриды,оксиды,пероксиды,гидрокиды щМе:хим.Связь в соединении и получение.
- •Получение Na,NaOh,Na2co3 в промыш.
- •Общая характеристика солей Be,Mg и щел.-зем. Металлов,их растворимость,гидролиз.
- •Оксид,гироксид,соли Al: их получение с св-ва
- •Оксиды углерода(II,IV):промышленное получение и в лаоратории,кислотно-основные и ов св-ва.Карбонилы металлов.
- •Оксиды и гироксиды Sn,Pb.Взаимодействие с к-ми и щелочами,ов св-ва.
- •Аммиак и гидрозин:получение,хим.Связь,строение полекулы,к-о,ов.
- •Гироксиламмин,азотистоводоодная к-та и её соли:хим.Связь,строение полекулы,получение и в-ва.
- •Фосфорноватистая и фосфорная к-ты:получение,строение молкулы,к-о св-ва,ов.Фосфиты,гипофосфиты.
- •Окиды фотфора:получение,строение молекулы,св-ва.
- •Получение и св-ва сероводорода.Растворимость и гидролиз сульфидов.Отношение сульфидов к кислотам.
- •Кислородосодержащие к-ты серы,селена и теллура:получение,к-о св-ва,ов св-ва.
- •Общая характеристика и св-ва меди,серебра,золота.
- •Общая характеристика и св-ва подгруппы Zn.
- •Общая характеристика и св-ва Cr,Mo,w.
- •Общая харктеристика и св-ва Mn,Tc,Re.
- •Маргонцевая к-та и её ангидлрид.
- •Диоксид марганца,манганаты,перманганаты.
- •Гидролиз солей по катиону,но аниону,совместнй гидролиз.
- •Химические свойства
- •Ассоциация молекул фтороводорода.Дифторид калия.
- •Оксиды Cl2,i2:получение и св-ва.
- •Галогенангидриды:получение и гидролиз.
Оксиды углерода(II,IV):промышленное получение и в лаоратории,кислотно-основные и ов св-ва.Карбонилы металлов.
СО-без цвета,запаха.мало растворим в воде.Очень ядовит,препятсвует переносу кислорода в токе крови.Несолеобразующий оксид.Для молекулы СО наиболее характерны восстановительные св-ва:
PdCl2+CO+H2O=Pd+CO2+2HCl
Однако из-за прочности связи,вос-ные св-ва проявляются при высокой t.
Fe2O3+3CO=2Fe+3CO2(t)
CO+S=COS(t)
Промыш.способ:1)Образуется при горении углерода или соединений на его основе (например, бензина) в условиях недостатка кислорода:2C + O2 → 2CO (тепловой эффект этой реакции 220 кДж),2) или при восстановлении диоксида углерода раскалённым углём:CO2 + C ↔ 2CO↑ (ΔH=172 кДж, ΔS=176 Дж/К).
Лаб.способ:
1)Нагревание смеси гексацианоферрата (II) калия с концентрированной серной кислотой. Реакция идёт по уравнению:K4[Fe(CN)6] + 6H2SO4 + 6H2O →(t) 2K2SO4 + FeSO4 + 3(NH4)2SO4 + 6CO↑2) Нагревание смеси щавелевой и концентрированной серной кислот. Реакция идёт по уравнению:H2C2O4 →(t, H2SO4) CO↑ + CO2↑ + H2O.
СО2-бесцветный газ,слегка кисловат на вкус.
В промышленности:
CaCO3=CaC+CO2
В лаб:( в аппарате Киппа)
CaCO3+2HCl↔CaCl2+CO2+H2O
Кислотный оксид,легко реагирует со щелочами и основными оксидами:
NaOH+CO2=NaHCO3.
Молекулы неполярные,поэтому плохо растворяются в воде.
Многие металлы реагируют с оксидом углерода непосредственно,находясь в мелкодисперсном состоянии.
Ni(порошок)+4CO=Ni(CO)4
Ni(CO)4=Ni+4CO(t)
Общий способ получения-вос-ние соединений металлов.
Fe(тв)+5CO(г)=[Fe(CO)5](p,t)
2MnI2+2Mg+10CO=Mn2(CO)10+2MgI2
Окисление: Fe(CO)5+H2SO4=FeSO4+5CO+H2
2Fe(CO)5+2KMnO4+H2O=Fe2O3+10CO+2MnO2+
2KOH
Ni(CO)4+Br2=NiBr2+4CO
Co(CO8)+2Na=2Na[Co(-2)(CO)4]
Fe(CO)5+3NaOH=Na[HFe(-2)(CO)4]+Na2CO3+H2O
[Fe(CO)5]+PPh3=[Fe(CO)4PPh3]+CO
[Fe(CO)5]+2PPh=[Fe(CO)3(PPh3)2]+2CO
Оксиды и гироксиды Sn,Pb.Взаимодействие с к-ми и щелочами,ов св-ва.
1)SnO2+6HCl(k)=H2[SnCl6]+2H2O
SnO2+2NaOH=Na2SnO3+H2O
2)PbO2+6HCl(k)=H2[PbCl4]+Cl2+2H2O
PbO2+4HCl(k)=PbCl4+2H2O(t≤0)
2PbO2+2H2SO4(k)=2H2[Pb(SO4)2]+O2+2H2O
PbO2+2NaOH+2H2O↔Na2[Pb(OH)6]
Сильный окислитель.
PbO2(влажн.) + 2H2S(газ)= PbS + S + 2H2O
3)PbO+2HNO3=Pb(NO3)2+H2O
PbO+2KOH(k)+H2O=K2[Pb(OH)4]
4)SnO+3HCl(k)=H[SnCl3]+H2O
SnO+H2SO4(p)=SnSO4+H2O
Восстановитель
![]()
![]()
5)Pb3O4-окислитель
Pb3O4+4HNO3=PbO2↓+2Pb(NO3)2+2H2O
Pb3O4+ 6NaOH(конц.) + 4H2O(гор.) =
2Na2[Pb(OH)4] + Na2[Pb(OH)6]
6)Sn(OH)2+NaOH=Na[Sn(OH)3]
Sn(OH)2+3HCl=H[SnCl3]+2H2O
Амфотерные св-ва
7)амфотерные св-ва
Pb(OH)2+4HCl(k)=H2[PbCl4]+2H2O
Pb(OH)2+2KOH=K2[Pb(OH)4]
Pb(OH)2+2HNO3=Pb(NO3)2+2H2O
Кварц,кремниевые кислоты,силикаты,гексафторокремниевая к-та:получение и св-ва.
Кварц SiO2. Получение.Na2SiO3 + 2CH3COOH →2CH3COONa+H2SiO3,кремниевая Кислота сразу разлагается на воду и SiO2, выпадающий в осадок.
Кислотный оксид с мало реакционной способностью.Не подвергается Cl2,Br2,инертен по отношению к большинству к-т и металлов,
формально явл.ок-лем.При обычных усл.реагирует с SiO2+6HF=H2SiF6+2H2O.При нагревании с оксидами различ.металлов образует силикаты.
Получ.
1)Метакремниевую кислоту получают действием
сильных кислот на соли метакремниевой кислоты:
Na2SiO3 + 2HCl = H2SiO3 + 2NaCl.
2)При высокой температуре вода выпаривается:
H2SiO3 = SiO2 + H2O
В этой реакции оксид кремния(IV) выделяется
виде силикагеля. Кремниевые кислоты — очень слабые, малорастворимые в воде кислоты. Известны соли метакремниевой кислоты Н2SiO3 (SiO2•H2О) — силикаты, ортокремниевой кислоты H4SiO4 (SiO2•2H2O) — ортосиликаты и других кислот с различным числом SiO2•nH2О. Гидраты кремнезема с содержанием более 2Н2О на каждую молекулу SiO2 в индивидуальном состоянии, по-видимому, не существуют, однако известны многие их соли. В воде кремниевые кислоты образуют коллоидные растворы.Соли кремниевых кислот называют силикатами (силикаты широко распространены в природе)Силикаты: 1)При нагревании SiO2 вытесняет более летучий кислотный оксид из солей:
SiO2 + Na2CO3 = Na2SiO3 + CO2↑
2)Обработка аморфного кремнезёма концентрированным раствором щёлочи:
SiO2 + 2NaOH = Na2SiO 3 + H2O
Силикаты взаимодействуют со следующими веществами:
1)С кислотами, даже с очень слабыми, например с угольной:
Na2SiO3 + H2CO3 = Na2CO3 + H2SiO3↓
2)С растворимыми солями:
Na2SiO3 + MgCl2 = MgSiO3↓ + 2NaCl
3)Гидролиз:
Na2SiO3 + H2O ↔ NaHSiO3 + NaOH
гексафторокремниевая к-та в свободном виде не выделена
H2SiF6↔SiF4+2HF(при упаривании или добав.к сильным кислотам.)
При охлаждении насыщенного водного р-ра выпадает дигидрат H2SiF6∙2H2O в виде твердого бесцветных кристаллов.На стекло кислота не действует.
Сульфиды олова и свинца:получение,кислотно-основыне св-ва и ОВ.Отношение к (NH4)2S,(NH4)2S2.
1)Получение:SnCl2+H2S↔2HCl+SnS↓
Pb(NO3)2+H2S↔2HNO3+PbS↓
Проявляют основные св-ва,но реагируют только с конц.к-ми.SnS+3HCl(k)=H[SnCl3]+H2S↑
2)
![]()
H2[SnCl6]+2H2S=6HCl+SnS2↓
SnS2-обладает кислотными в-ми и хорошо р-рим в щелочах:
3SnS2+6NaOH=2Na2SnS3+Na2[Sn(OH)6]
(NH4)2(S) + SnS2 = (NH4)2[SnS3] + (n – 1)S↓
Р-ции t-разложения солей аммония:нитрита,нитрата,бихромата,сульфата,хлорида.
NH4NO3 → N2O↑ + 2Н2O
(NH4)2Cr2O7 → N2↑ + Cr2O3+ 4Н2O
NH4NO2 = N2 + 2H2O
(NH4)2SO4 = NH4HSO4 + NH3
NH4Cl = NH3 + HCl
Оксиды азота:получение,строение молекулы,ОВ св-ва.
1)NO-безцветный газ,мало растворим в воде.,в жидком с-ние голубоватый.Молекула содержит нечетное число эл-нов,парамагнитна,кратность связи 2,5.Обладает высокой реакционной способностью.Промышленный способ:
![]()
![]()
![]() вос.св-ва,с более
сильными в-лями проявл.ок-ные св-ва.
вос.св-ва,с более
сильными в-лями проявл.ок-ные св-ва.
2)N2O-без цвета,сладковатый запах.Молеекула изоэлектронна и имеет линейное строение
(-)N=N(+)=O
Получение:NH4NO3=N2O+2H2O(t)
Несолеобразующий оксид.
При нагревании проявляет свойства окислителя.
![]()
При взаимодействии с сильными окислителями N2O может проявлять свойства восстановителя:
5N2O+8KMnO4+7H2SO4=5Mn(NO3)2+3MnSO4
+4K2SO4+7H2O
3)N2O3-неустойчивая жидкость.
![]()
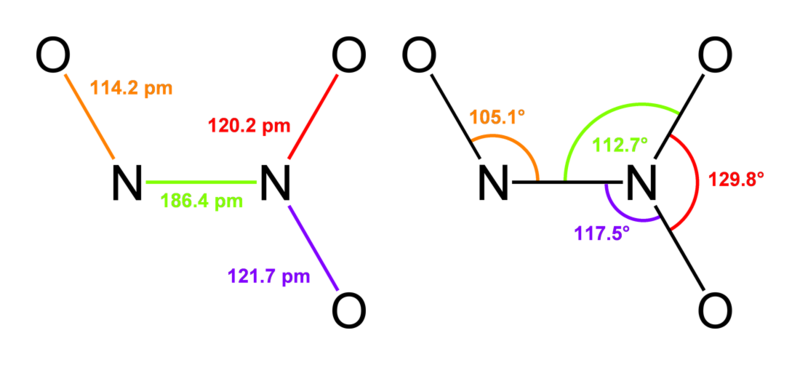
4)NO2-ядовитый газ,бурого цвета.
Получение 2Pb(NO3)2=2PbO+4NO2+O2
O-N-O=132◦,имеет угловую форму,парамагнитна.
N2O5-бесцветное кристаллическое в-во легко возгарается.

Сильный окислитель.Получение:
![]()
![]()
или![]()
