
- •Предмет физики. Методы физического исследования. Физические модели. Роль физики в становлении инженера.
- •2. Элементы кинематики материальной точки. Система отсчёта. Радиус-вектор. Скорость и ускорение как производные радиус-вектора по времени. Уравнения движения. Одномерное движение.
- •3. Криволинейное движение. Нормальное и тангенциальное ускорения.
- •4. Элементы кинематики вращательного движения: угловая скорость и угловое ускорение, их связь с линейными скоростями и ускорениями.
- •5. Первый закон Ньютона и понятие инерциальной и неинерциальной системы отсчёта. Масса и импульс. Понятие состояния в классической механике.
- •6. Второй закон Ньютона, как уравнение движения. Сила, как производная импульса. Закон сохранения импульса.
- •7. Третий закон Ньютона.
- •8. Механическая система. Центр инерции (масс) механической системы. Теорема о движении центра инерции.
- •9. Работа силы и её выражение через криволинейный интеграл. Консервативные и неконсервативные силы. Работа силы (сил) над одной точкой
- •10. Кинетическая энергия. Потенциальная энергия материальной точки во внешнем силовом поле. Понятие о градиенте скалярной функции координат.
- •11. Закон сохранения энергии в механике. Общефизический закон сохранения энергии.
- •12. Удар абсолютно упругих и неупругих тел.
- •13. Момент силы и момент импульса.
- •14. Уравнение динамики вращательного движения твёрдого тела.
- •15. Момент инерции материальной точки.
- •16. Момент инерции тела относительно неподвижной оси. Теорема Штейнера.
- •17. Момент импульса механической системы. Закон сохранения момента импульса.
- •18. Кинетическая энергия вращающегося тела.
- •19. Неинерциальные системы отсчёта. Сила инерции. Сила Кориолиса. Основной закон динамики в неинерциальных системах.
- •20. Преобразования Галилея. Механический принцип относительности.
- •21. Постулаты специальной теории относительности.
- •22. Преобразования Лоренца. Относительность длин и промежутков времени. Релятивистский закон сложения скоростей.
- •23. Релятивистский импульс. Основной закон релятивистской динамики материальной точки.
- •24. Взаимосвязь массы и энергии. Соотношение между полной энергией и импульсом частицы. Релятивистское выражение для кинетической энергии.
- •25. Статистический и термодинамический методы исследования.Давление газа с точки зрения мкт
- •26. Уравнение состояния идеального газа
- •27.Средняя кинетическая энергия. Молекулярно кинетическое толкование абсолютной температуры
- •28.Работа газа. Количество теплоты. Теплоемкость
- •30.Число степеней свободы. Закон равномерного распределения энергии по степеням свободы
- •31.Барометрическая формула. Распределение Больцмана
- •32.Принцип детального равновесия. Среднее число столкновений и средняя длина свободного пробега молекул
- •33.Опытные законы диффузии, теплопроводности и внутреннего трения.
- •34.Молекулярно- кинетическая теория явлений переноса в неравновесной системе
- •35. Работа газа при изменении его объема. Внутренняя энергия термодинамической системы.
- •36.Количество теплоты. Первое начало термодинамики. Применение первого начала к изопроцессам
- •37. Теплоемкость. Удельная и молярная теплоемкости. Зависимость теплоемкости идеального газа от вида процесса. Недостаточность классической теории теплоемкости.
- •38.Адиабатный процесс. Уравнение Паусона
- •39. Обратимые и необратимые тепловые процессы. Круговые процессы.
- •40.Цикл Карно и его кпд. Тепловые двигатели и холодильные машины
- •41. Второе начало термодинамики. Приведенная теплота
- •42. Энтропия. Принцип возрастания энтропии. Энтропия идеального газа
- •43. Третье начало термодинамики
- •44. Термодинамическая вероятность. Определение энтропии неравновесной системы через термодинамическую вероятность состояния.
- •45. Силы и потенциальная энергия межмолекулярного взаимодействия. Эффективный диаметр молекул.
- •46.Уравнение Ван-дер-Ваальса. Изотермы Ван-дер-Ваальса и их анализ
- •47. Метастабильные состояния. Критическая тачка. Внутренняя энергия реальных газов
- •48. Понятие фазы, фазового равновесия и превращения. Правила фаз Гиббса
- •49.Фазовый переход первого и второго рода. Диаграммы состояния. Тройная точка.
43. Третье начало термодинамики
При температуре абсолютного нуля система находится в основном состоянии, которое реализуется одним единственным способом. Следовательно, термодинамическая вероятность в данном случае равняется 1, а энтропия равняется нулю. Обобщая данное высказывание можно написать следующее выражение, которое является теоремой Нернста или 3 началом термодинамики.
![]() .
(5.11)
.
(5.11)
При стремлении к нулю абсолютной температуры энтропия термодинамической системы также стремится к нулю
44. Термодинамическая вероятность. Определение энтропии неравновесной системы через термодинамическую вероятность состояния.
Термодинамическая
вероятность — число способов, которыми
может быть реализовано состояние
физической системы. В термодинамике
состояние физической системы
характеризуется определёнными значениями
плотности,
давления,
температуры
и др. измеримых величин. Перечисленные
величины определяют состояние системы
в целом (её макросостояние). Однако при
одной и той же плотности, температуре
и т. д. частицы системы могут
различными способами распределиться
в пространстве и иметь различные
импульсы. Каждое данное распределение
частиц называется микросостоянием
системы. Вероятность термодинамическая
(обозначается W) равна числу микросостояний,
реализующих данное макросостояние, из
чего следует, что
![]() .
Вероятность термодинамическая связана
с одной из основных макроскопических
характеристик системы энтропией
S соотношением Больцмана:
.
Вероятность термодинамическая связана
с одной из основных макроскопических
характеристик системы энтропией
S соотношением Больцмана:
![]() ,
где
,
где
![]() —
Больцмана
постоянная.
—
Больцмана
постоянная.
Термодинамическая энтропия S, часто просто именуемая энтропия, в химии и термодинамике является функцией состояния термодинамической системы.
Понятие
энтропии было впервые введено в 1865 году
Рудольфом
Клаузиусом.
Он определил изменение энтропии
термодинамической системы при обратимом
процессе как отношение общего количества
тепла
![]() к
величине абсолютной
температуры
к
величине абсолютной
температуры
![]() (то
есть тепло, переданное системе, при
постоянной температуре):
(то
есть тепло, переданное системе, при
постоянной температуре):
![]() .
.
Эта формула применима только для изотермического процесса (происходящего при постоянной температуре) выглядит так:
,
где — приращение (дифференциал) энтропии некоторой системы, а — бесконечно малое количество теплоты, полученное этой системой.
Поскольку энтропия является функцией состояния, в левой части равенства стоит её полный дифференциал. Напротив, количество теплоты является функцией процесса, в котором эта теплота была передана, поэтому считать полным дифференциалом нельзя.
Энтропия, таким образом, согласно вышеописанному, определена вплоть до произвольной аддитивной постоянной. Третье начало термодинамики позволяет определить её точнее: предел величины энтропии равновесной системы при стремлении температуры к абсолютному нулю полагают равным нулю.
45. Силы и потенциальная энергия межмолекулярного взаимодействия. Эффективный диаметр молекул.
В![]() нутренняя
энергия реального газа складывается
из кинетической энергии теплового
движения его молекул, которая определяет
внутреннюю энергию идеального газа и
потенциальную энергию межмолекулярного
взаимодействия. Потенциальная энергия
реального газа обусловлена только
силами притяжения между молекулами.
Наличие сил притяжения приводит к
возникновению внутреннего давления на
газ_
нутренняя
энергия реального газа складывается
из кинетической энергии теплового
движения его молекул, которая определяет
внутреннюю энергию идеального газа и
потенциальную энергию межмолекулярного
взаимодействия. Потенциальная энергия
реального газа обусловлена только
силами притяжения между молекулами.
Наличие сил притяжения приводит к
возникновению внутреннего давления на
газ_
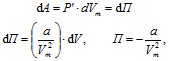
Работа, которая затрачивается на преодоление сил притяжения, действующих между молекулами газа, идет на увеличение потенциальной энергии системы._
г![]() де
постоянная интегрирования
принята равной нулю. Знак «–» означает,
что молекулярные силы, создающие
внутреннее давление P′, являются силами
притяжения. Учитывая оба слагаемых,
получим, что внутренняя энергия моля
реального газа_
де
постоянная интегрирования
принята равной нулю. Знак «–» означает,
что молекулярные силы, создающие
внутреннее давление P′, являются силами
притяжения. Учитывая оба слагаемых,
получим, что внутренняя энергия моля
реального газа_
растет с повышением температуры и увеличением объема.
П ри
рассмотрении реальных
газов —
ри
рассмотрении реальных
газов —
газов, свойства которых зависят от взаимодействия молекул, надо учитывать силы межмолекулярного взаимодействия. Они
проявляются на расстояниях 10-9 м и быстро убывают при увеличении расстояния между молекулами. Такие силы называются короткодействующими.
В XX в., по мере развития представлений о строении атома и квантовой механики, было выяснено, что между молекулами вещества одновременно действуют силы притяжения и силы отталкивания. На рис. 88, а приведена качественная зависимость сил межмолекулярного взаимодействия от расстояния r между молекулами, где Fo и Fп — соответственно силы отталкивания и притяжения, a F — их результирующая. Силы отталкивания считаются положительными, а силы взаимного притяжения — отрицательными.
Элементарная работа A силы F при увеличении расстояния между молекулами на dr совершается за счет уменьшения взаимной потенциальной энергии молекул, т. е.
A=Fdr=-dП. (1)
Эффективный диаметр молекул d - это минимальное расстояние, на которое сближаются при столкновении центры двух молекул. Величина s =p d2 называется эффективным сечением молекулы.
