
- •Предмет физики. Методы физического исследования. Физические модели. Роль физики в становлении инженера.
- •2. Элементы кинематики материальной точки. Система отсчёта. Радиус-вектор. Скорость и ускорение как производные радиус-вектора по времени. Уравнения движения. Одномерное движение.
- •3. Криволинейное движение. Нормальное и тангенциальное ускорения.
- •4. Элементы кинематики вращательного движения: угловая скорость и угловое ускорение, их связь с линейными скоростями и ускорениями.
- •5. Первый закон Ньютона и понятие инерциальной и неинерциальной системы отсчёта. Масса и импульс. Понятие состояния в классической механике.
- •6. Второй закон Ньютона, как уравнение движения. Сила, как производная импульса. Закон сохранения импульса.
- •7. Третий закон Ньютона.
- •8. Механическая система. Центр инерции (масс) механической системы. Теорема о движении центра инерции.
- •9. Работа силы и её выражение через криволинейный интеграл. Консервативные и неконсервативные силы. Работа силы (сил) над одной точкой
- •10. Кинетическая энергия. Потенциальная энергия материальной точки во внешнем силовом поле. Понятие о градиенте скалярной функции координат.
- •11. Закон сохранения энергии в механике. Общефизический закон сохранения энергии.
- •12. Удар абсолютно упругих и неупругих тел.
- •13. Момент силы и момент импульса.
- •14. Уравнение динамики вращательного движения твёрдого тела.
- •15. Момент инерции материальной точки.
- •16. Момент инерции тела относительно неподвижной оси. Теорема Штейнера.
- •17. Момент импульса механической системы. Закон сохранения момента импульса.
- •18. Кинетическая энергия вращающегося тела.
- •19. Неинерциальные системы отсчёта. Сила инерции. Сила Кориолиса. Основной закон динамики в неинерциальных системах.
- •20. Преобразования Галилея. Механический принцип относительности.
- •21. Постулаты специальной теории относительности.
- •22. Преобразования Лоренца. Относительность длин и промежутков времени. Релятивистский закон сложения скоростей.
- •23. Релятивистский импульс. Основной закон релятивистской динамики материальной точки.
- •24. Взаимосвязь массы и энергии. Соотношение между полной энергией и импульсом частицы. Релятивистское выражение для кинетической энергии.
- •25. Статистический и термодинамический методы исследования.Давление газа с точки зрения мкт
- •26. Уравнение состояния идеального газа
- •27.Средняя кинетическая энергия. Молекулярно кинетическое толкование абсолютной температуры
- •28.Работа газа. Количество теплоты. Теплоемкость
- •30.Число степеней свободы. Закон равномерного распределения энергии по степеням свободы
- •31.Барометрическая формула. Распределение Больцмана
- •32.Принцип детального равновесия. Среднее число столкновений и средняя длина свободного пробега молекул
- •33.Опытные законы диффузии, теплопроводности и внутреннего трения.
- •34.Молекулярно- кинетическая теория явлений переноса в неравновесной системе
- •35. Работа газа при изменении его объема. Внутренняя энергия термодинамической системы.
- •36.Количество теплоты. Первое начало термодинамики. Применение первого начала к изопроцессам
- •37. Теплоемкость. Удельная и молярная теплоемкости. Зависимость теплоемкости идеального газа от вида процесса. Недостаточность классической теории теплоемкости.
- •38.Адиабатный процесс. Уравнение Паусона
- •39. Обратимые и необратимые тепловые процессы. Круговые процессы.
- •40.Цикл Карно и его кпд. Тепловые двигатели и холодильные машины
- •41. Второе начало термодинамики. Приведенная теплота
- •42. Энтропия. Принцип возрастания энтропии. Энтропия идеального газа
- •43. Третье начало термодинамики
- •44. Термодинамическая вероятность. Определение энтропии неравновесной системы через термодинамическую вероятность состояния.
- •45. Силы и потенциальная энергия межмолекулярного взаимодействия. Эффективный диаметр молекул.
- •46.Уравнение Ван-дер-Ваальса. Изотермы Ван-дер-Ваальса и их анализ
- •47. Метастабильные состояния. Критическая тачка. Внутренняя энергия реальных газов
- •48. Понятие фазы, фазового равновесия и превращения. Правила фаз Гиббса
- •49.Фазовый переход первого и второго рода. Диаграммы состояния. Тройная точка.
40.Цикл Карно и его кпд. Тепловые двигатели и холодильные машины
Энергия не исчезает и не возникает, она непрерывно превращается из одного вида в другой.
![]() - Первое начало
термодинамики.
- Первое начало
термодинамики.
Это причинно-следственная связь отражает возможность преобразования энергии из одного вида в другой.

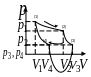 Тепловая
энергия
Тепловая
энергия
![]() работу
работу
Термодинамический цикл
Самый простой цикл с максимальным К.П.Д.
- Цикл Карно (самый эффективный). Обеспечивает максимальное преобразование из тепловой энергии в механическую.
Будем рассматривать газовую МСС.

Цикл Карно состоит из двух изотерм и двух адиабат.
при
![]()
![]() и
и
![]()
при
![]()
![]() и
и
![]()
Схема
идеальной тепловой машины – это система
имеющая: 1) нагреватель
![]() ,
2) рабочее тело (газовая МСС, которая
осуществляет переходы), 3) холодильник
,
2) рабочее тело (газовая МСС, которая
осуществляет переходы), 3) холодильник
![]() ,
4) механизм.
,
4) механизм.
41. Второе начало термодинамики. Приведенная теплота
![]() - Первое начало
термодинамики.
- Первое начало
термодинамики.
![]() - количество теплоты,
которое получила МСС. Информация о
воздействии на МСС.
- количество теплоты,
которое получила МСС. Информация о
воздействии на МСС.
![]() - работа, механическое
воздействие. Реакция системы на
воздействие.
- работа, механическое
воздействие. Реакция системы на
воздействие.
Эта работа считается положительной, если она производится самой механической системой.
Первое начало термодинамики дает ответ на вопрос: Каким образом можно заставить систему перейти из одного состояния в другое.
![]()
![]()
![]()
В общем случае
![]()
![]() - математическая
формулировка второго начала термодинамики.
- математическая
формулировка второго начала термодинамики.
Система перейдет в такое состояние, в котором энтропия соответствует либо исходному состоянию систему, либо превышает это значение.
![]()
![]()
![]() - переход в новое
состояние является обратным.
- переход в новое
состояние является обратным.
П
 роцесс
называется обратимым, если переход из
1 в 2 и из 2 в 1 идет через те же промежуточные
состояния.
роцесс
называется обратимым, если переход из
1 в 2 и из 2 в 1 идет через те же промежуточные
состояния.
- обратный процесс
- необратимый процесс
В результате воздействия, тело переходит в состояние с большим значением энтропии.
Следствия:
1. Природа запрещает самопроизвольную передачу количество теплоты от менее нагретого к более нагретому.
2. Запрещено создание вечных двигателей, т. е. создание преобразователя тепловой энергии в механическую с К.П.Д.=100%
42. Энтропия. Принцип возрастания энтропии. Энтропия идеального газа
![]() Энтропия
– функция состояния термодинамической
системы, изменение которой dS в равновесном
процессе равно отношению количества
теплоты dQ, сообщенного системе или
отведенного от нее, к термодинамической
температуре Т системы . Где
Энтропия
– функция состояния термодинамической
системы, изменение которой dS в равновесном
процессе равно отношению количества
теплоты dQ, сообщенного системе или
отведенного от нее, к термодинамической
температуре Т системы . Где
![]() —
приращение энтропии;
—
приращение энтропии;
![]() —
минимальная теплота, подведенная к
системе; T — абсолютная температура
процесса;
—
минимальная теплота, подведенная к
системе; T — абсолютная температура
процесса;
Принцип
возрастания энтропии справедлив для
любой изолированной системы. Это
обстоятельство указывает на
однонаправленность происходящих в ней
процессов.
![]()
![]()
![]() - число степеней свободы
- число степеней свободы
![]() - количество вещества
- количество вещества
- ее температура
![]() - объем
- объем
![]()
![]() (экстенсивный параметр)
(экстенсивный параметр)
Энтропия системы зависит от количества частиц в ее составе.
![]() - третье
начало термодинамики.
- третье
начало термодинамики.
При стремление температуры к 0, энтропия становиться 0.
![]()
Теплоемкость любой системы при приближении температуры к абсолютному 0 равна 0.
Теория Дебая для теплоемкости.

