
- •Предмет физики. Методы физического исследования. Физические модели. Роль физики в становлении инженера.
- •2. Элементы кинематики материальной точки. Система отсчёта. Радиус-вектор. Скорость и ускорение как производные радиус-вектора по времени. Уравнения движения. Одномерное движение.
- •3. Криволинейное движение. Нормальное и тангенциальное ускорения.
- •4. Элементы кинематики вращательного движения: угловая скорость и угловое ускорение, их связь с линейными скоростями и ускорениями.
- •5. Первый закон Ньютона и понятие инерциальной и неинерциальной системы отсчёта. Масса и импульс. Понятие состояния в классической механике.
- •6. Второй закон Ньютона, как уравнение движения. Сила, как производная импульса. Закон сохранения импульса.
- •7. Третий закон Ньютона.
- •8. Механическая система. Центр инерции (масс) механической системы. Теорема о движении центра инерции.
- •9. Работа силы и её выражение через криволинейный интеграл. Консервативные и неконсервативные силы. Работа силы (сил) над одной точкой
- •10. Кинетическая энергия. Потенциальная энергия материальной точки во внешнем силовом поле. Понятие о градиенте скалярной функции координат.
- •11. Закон сохранения энергии в механике. Общефизический закон сохранения энергии.
- •12. Удар абсолютно упругих и неупругих тел.
- •13. Момент силы и момент импульса.
- •14. Уравнение динамики вращательного движения твёрдого тела.
- •15. Момент инерции материальной точки.
- •16. Момент инерции тела относительно неподвижной оси. Теорема Штейнера.
- •17. Момент импульса механической системы. Закон сохранения момента импульса.
- •18. Кинетическая энергия вращающегося тела.
- •19. Неинерциальные системы отсчёта. Сила инерции. Сила Кориолиса. Основной закон динамики в неинерциальных системах.
- •20. Преобразования Галилея. Механический принцип относительности.
- •21. Постулаты специальной теории относительности.
- •22. Преобразования Лоренца. Относительность длин и промежутков времени. Релятивистский закон сложения скоростей.
- •23. Релятивистский импульс. Основной закон релятивистской динамики материальной точки.
- •24. Взаимосвязь массы и энергии. Соотношение между полной энергией и импульсом частицы. Релятивистское выражение для кинетической энергии.
- •25. Статистический и термодинамический методы исследования.Давление газа с точки зрения мкт
- •26. Уравнение состояния идеального газа
- •27.Средняя кинетическая энергия. Молекулярно кинетическое толкование абсолютной температуры
- •28.Работа газа. Количество теплоты. Теплоемкость
- •30.Число степеней свободы. Закон равномерного распределения энергии по степеням свободы
- •31.Барометрическая формула. Распределение Больцмана
- •32.Принцип детального равновесия. Среднее число столкновений и средняя длина свободного пробега молекул
- •33.Опытные законы диффузии, теплопроводности и внутреннего трения.
- •34.Молекулярно- кинетическая теория явлений переноса в неравновесной системе
- •35. Работа газа при изменении его объема. Внутренняя энергия термодинамической системы.
- •36.Количество теплоты. Первое начало термодинамики. Применение первого начала к изопроцессам
- •37. Теплоемкость. Удельная и молярная теплоемкости. Зависимость теплоемкости идеального газа от вида процесса. Недостаточность классической теории теплоемкости.
- •38.Адиабатный процесс. Уравнение Паусона
- •39. Обратимые и необратимые тепловые процессы. Круговые процессы.
- •40.Цикл Карно и его кпд. Тепловые двигатели и холодильные машины
- •41. Второе начало термодинамики. Приведенная теплота
- •42. Энтропия. Принцип возрастания энтропии. Энтропия идеального газа
- •43. Третье начало термодинамики
- •44. Термодинамическая вероятность. Определение энтропии неравновесной системы через термодинамическую вероятность состояния.
- •45. Силы и потенциальная энергия межмолекулярного взаимодействия. Эффективный диаметр молекул.
- •46.Уравнение Ван-дер-Ваальса. Изотермы Ван-дер-Ваальса и их анализ
- •47. Метастабильные состояния. Критическая тачка. Внутренняя энергия реальных газов
- •48. Понятие фазы, фазового равновесия и превращения. Правила фаз Гиббса
- •49.Фазовый переход первого и второго рода. Диаграммы состояния. Тройная точка.
27.Средняя кинетическая энергия. Молекулярно кинетическое толкование абсолютной температуры
Кинети́ческая эне́ргия — энергия механической системы, зависящая от скоростей движения её точек. Часто выделяют кинетическую энергию поступательного и вращательного движения.
T = t + 273
Температура — мера средней кинетической энергии молекул.
![]()
Средняя кинетическая энергия хаотического движения молекул газа пропорциональна абсолютной температуре.
<E> = m0<v2>
<vкв>
= ![]() 2>
2>
Сравнивая уравнение состояния идеального газа и основное уравнение кинетической теории газов, записанные для одного моля (для этого число молекул N возьмём равным числу Авогадро NА), найдём среднюю кинетическую энергию одной молекулы:
![]() и
и
![]() .
NА=6.02*1023
моль-1
R=
8.31 дж/моль*К
.
NА=6.02*1023
моль-1
R=
8.31 дж/моль*К
Откуда
![]() .
(31)
.
(31)
Средняя кинетическая энергия поступательного движения молекулы не зависит от её природы и пропорциональна абсолютной температуре газа T. Отсюда следует, что абсолютная температура является мерой средней кинетической энергии молекул.
Величина R/NА = k в уравнении (31) получила название постоянной Больцмана и представляет собой газовую постоянную, отнесенную к одной молекуле: k = 1,38·10-23 Дж/К-23.
Так
как
 =
=![]() kТ,
то средняя квадратичная скорость равна
kТ,
то средняя квадратичная скорость равна
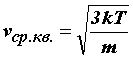
Молекулярно-кинетическое толкование абсолютной температуры.
С точки зрения молекулярно-кинетической теории абсолютная температура есть величина, пропорциональная средней энергии поступательного движения молекулы. <e пост>=3/2kT.
28.Работа газа. Количество теплоты. Теплоемкость
Работа в термодинамики
А=р∆V (p=const)
A=![]() (p=const)
(p=const)
Q
-
энергия, которую тело теряет или
приобретает при передаче тепла.
Формула
количества теплоты зависит
от протекающего процесса.
Формулы
количества теплоты при некоторых
процессах:
![]() Количество
теплоты при нагревании и охлаждении.
Количество
теплоты при нагревании и охлаждении.
![]() Количество
теплоты при плавлении или
кристаллизации.
Количество
теплоты при плавлении или
кристаллизации.
![]() Количество
теплоты при кипении, испарении жидкости
и конденсации пара.
Количество
теплоты при кипении, испарении жидкости
и конденсации пара.
![]() Количество
теплоты при сгорании топлива.
Количество
теплоты всегда передается от
более горячих тел
к более
холодным
до достижения ими одинаковой температуры
(теплового равновесия), если нет иных
процессов, кроме теплопередачи.
В
замкнутой системе тел выполняется
уравнение теплового балланса: Q1
+ Q2
+ ... = 0 -
количество теплоты, которое теряют
горячие тела, равно количеству тепла,
получаемому холодными.
Полезные
формулы:
К
Количество
теплоты при сгорании топлива.
Количество
теплоты всегда передается от
более горячих тел
к более
холодным
до достижения ими одинаковой температуры
(теплового равновесия), если нет иных
процессов, кроме теплопередачи.
В
замкнутой системе тел выполняется
уравнение теплового балланса: Q1
+ Q2
+ ... = 0 -
количество теплоты, которое теряют
горячие тела, равно количеству тепла,
получаемому холодными.
Полезные
формулы:
К![]() оличество
теплоты, переданное телу,
идет на
изменение его внутренней энергии
и
на совершение им работы (Первый закон
термодинамики).
Закон
Джоуля-Ленца: в
неподвижном металлическом проводнике
вся энергия электрического
тока
превращается в тепло:
оличество
теплоты, переданное телу,
идет на
изменение его внутренней энергии
и
на совершение им работы (Первый закон
термодинамики).
Закон
Джоуля-Ленца: в
неподвижном металлическом проводнике
вся энергия электрического
тока
превращается в тепло:
![]() -
закон Джоуля
- Ленца. Q -
количество теплоты Дж;
-
закон Джоуля
- Ленца. Q -
количество теплоты Дж;
ΔU - изменение внутренней энергии Дж; с - удельная теплоемкость вещества Дж/кг·К;
A' - работа газа Дж m - масса газа кг; T - абсолютная температура газа (to + 273) К; С λ - удельная теплота плавления и кристаллизации Дж/кг; r - удельная теплота парообразования и конденсации Дж/кг; q - теплота сгорания топлива Дж/кг; U - напряжение на проводнике В; I - сила тока в проводнике А; R - сопротивление проводника Ом; t - время протекания тока с
ТЕПЛОЕМКОСТЬ, кол-во теплоты, затрачиваемое для изменения т-ры на 1 °С.
![]()
где ΔQ - количество теплоты, сообщенное системе и вызвавшее изменение ее температуры на Delta;T. Отношение конечных разностей ΔQ/ΔТ называется средней теплоемкостю, отношение бесконечно малых величин dQ/dT - истинной теплоемкостю.
29.Вероятность и флуктуация. Функция распределения вероятностей. Закон Максвелла для распределения молекул идеального газа по скоростям и энергиям их теплового движения. Средние скорости теплового движения частиц
Вероятностей теория, математическая наука, позволяющая по вероятностям одних случайных событий находить вероятности других случайных событий, связанных каким-либо образом с первыми.
Основные понятия теории вероятностей. Наиболее просто определяются основные понятия Вероятностей теория как математической дисциплины в рамках так называемой элементарной Вероятностей теория Каждое испытание Т, рассматриваемое в элементарной Вероятностей теория, таково, что оно заканчивается одним и только одним из событий E1, E2,..., ES (тем или иным, в зависимости от случая). Эти события называются исходами испытания. С каждым исходом Ek связывается положительное число рк - вероятность этого исхода. Числа pk должны при этом в сумме давать единицу. Рассматриваются затем события А, заключающиеся в том, что «наступает или Ei, или Ej,..., или Ek». Исходы Ei, Ej,..., Ek называются благоприятствующими А, и по определению полагают вероятность Р (А) события А, равной сумме вероятностей благоприятствующих ему исходов: P (A) = pi + ps + … + pk. (1) Частный случай p1 = p2 =... ps = 1/S приводит к формуле Р (А) = r/s. (2) Формула (2) выражает так называемое классическое определение вероятности, в соответствии с которым вероятность какого-либо события А равна отношению числа r исходов, благоприятствующих А, к числу s всех «равновозможных» исходов. Классическое определение вероятности лишь сводит понятие «вероятности» к понятию «равновозможности», которое остаётся без ясного определения.
Флуктуации
(от лат. fluctuatio – колебание), случайные
отклонения наблюдаемых физических
величин от их средних значений. Флуктуации
происходят у любых величин, зависящих
от случайных факторов и описываемых
методами статистики Количественная
характеристика Флуктуации
основана на методах математической
статистики
и вероятностей
теории.
Простейшей мерой Флуктуации
величины х
служит её дисперсия
s2x,
т. е.
средний квадрат отклонения х
от её среднего значения
![]() ,
s2x
=
,
s2x
=
![]() ,
где черта
сверху означает статистическое
усреднение.
Флуктуации
справедливо и в случае квантовой
статистики, различаются лишь явные
выражения для CV.
Для систем с постоянным объёмом в
контакте с термостатом и резервуаром
частиц большое каноническое распределение
Гиббса даёт для Флуктуации
числа частиц:
,
где черта
сверху означает статистическое
усреднение.
Флуктуации
справедливо и в случае квантовой
статистики, различаются лишь явные
выражения для CV.
Для систем с постоянным объёмом в
контакте с термостатом и резервуаром
частиц большое каноническое распределение
Гиббса даёт для Флуктуации
числа частиц:
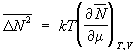 ,
где m –
химический
потенциал.
В приведённых примерах флуктуируют
пропорциональные объёму (т. н. экстенсивные)
величины.
,
где m –
химический
потенциал.
В приведённых примерах флуктуируют
пропорциональные объёму (т. н. экстенсивные)
величины.
Закон Максвелла для распределения молекул идеального газа по скоростям теплового движения. В 1860 году Максвелл теоретически установил распределение молекул идеального газа по скоростям теплового движения и записал в виде F(v)=f(v)4p v2 и позже получил то, что впоследствии назвал формулой распределения молекул идеального газа по скоростям теплового движения. Она имеет вид F(v)=(m/(2p kT))3/2exp(-mv2/(2kT))4p v2. Вероятностное толкование закона распределения Максвелла. Выражение dNv=Nf(v)4p v2dv даёт число молекул, величина скоростей которых лежит в интервале от v до v+dv. Разделив его на n получим вероятность того, что скорость молекулы окажется между v и v+dv, то есть dPv=f(v)4p v2dv.
Средняя скорость теплового движения частицы вычисляется по формуле v=√ (3kT/m)
(m — масса броуновской частицы, v — ее скорость, k — постоянная Больцмана, T — температура
