
- •Предмет физики. Методы физического исследования. Физические модели. Роль физики в становлении инженера.
- •2. Элементы кинематики материальной точки. Система отсчёта. Радиус-вектор. Скорость и ускорение как производные радиус-вектора по времени. Уравнения движения. Одномерное движение.
- •3. Криволинейное движение. Нормальное и тангенциальное ускорения.
- •4. Элементы кинематики вращательного движения: угловая скорость и угловое ускорение, их связь с линейными скоростями и ускорениями.
- •5. Первый закон Ньютона и понятие инерциальной и неинерциальной системы отсчёта. Масса и импульс. Понятие состояния в классической механике.
- •6. Второй закон Ньютона, как уравнение движения. Сила, как производная импульса. Закон сохранения импульса.
- •7. Третий закон Ньютона.
- •8. Механическая система. Центр инерции (масс) механической системы. Теорема о движении центра инерции.
- •9. Работа силы и её выражение через криволинейный интеграл. Консервативные и неконсервативные силы. Работа силы (сил) над одной точкой
- •10. Кинетическая энергия. Потенциальная энергия материальной точки во внешнем силовом поле. Понятие о градиенте скалярной функции координат.
- •11. Закон сохранения энергии в механике. Общефизический закон сохранения энергии.
- •12. Удар абсолютно упругих и неупругих тел.
- •13. Момент силы и момент импульса.
- •14. Уравнение динамики вращательного движения твёрдого тела.
- •15. Момент инерции материальной точки.
- •16. Момент инерции тела относительно неподвижной оси. Теорема Штейнера.
- •17. Момент импульса механической системы. Закон сохранения момента импульса.
- •18. Кинетическая энергия вращающегося тела.
- •19. Неинерциальные системы отсчёта. Сила инерции. Сила Кориолиса. Основной закон динамики в неинерциальных системах.
- •20. Преобразования Галилея. Механический принцип относительности.
- •21. Постулаты специальной теории относительности.
- •22. Преобразования Лоренца. Относительность длин и промежутков времени. Релятивистский закон сложения скоростей.
- •23. Релятивистский импульс. Основной закон релятивистской динамики материальной точки.
- •24. Взаимосвязь массы и энергии. Соотношение между полной энергией и импульсом частицы. Релятивистское выражение для кинетической энергии.
- •25. Статистический и термодинамический методы исследования.Давление газа с точки зрения мкт
- •26. Уравнение состояния идеального газа
- •27.Средняя кинетическая энергия. Молекулярно кинетическое толкование абсолютной температуры
- •28.Работа газа. Количество теплоты. Теплоемкость
- •30.Число степеней свободы. Закон равномерного распределения энергии по степеням свободы
- •31.Барометрическая формула. Распределение Больцмана
- •32.Принцип детального равновесия. Среднее число столкновений и средняя длина свободного пробега молекул
- •33.Опытные законы диффузии, теплопроводности и внутреннего трения.
- •34.Молекулярно- кинетическая теория явлений переноса в неравновесной системе
- •35. Работа газа при изменении его объема. Внутренняя энергия термодинамической системы.
- •36.Количество теплоты. Первое начало термодинамики. Применение первого начала к изопроцессам
- •37. Теплоемкость. Удельная и молярная теплоемкости. Зависимость теплоемкости идеального газа от вида процесса. Недостаточность классической теории теплоемкости.
- •38.Адиабатный процесс. Уравнение Паусона
- •39. Обратимые и необратимые тепловые процессы. Круговые процессы.
- •40.Цикл Карно и его кпд. Тепловые двигатели и холодильные машины
- •41. Второе начало термодинамики. Приведенная теплота
- •42. Энтропия. Принцип возрастания энтропии. Энтропия идеального газа
- •43. Третье начало термодинамики
- •44. Термодинамическая вероятность. Определение энтропии неравновесной системы через термодинамическую вероятность состояния.
- •45. Силы и потенциальная энергия межмолекулярного взаимодействия. Эффективный диаметр молекул.
- •46.Уравнение Ван-дер-Ваальса. Изотермы Ван-дер-Ваальса и их анализ
- •47. Метастабильные состояния. Критическая тачка. Внутренняя энергия реальных газов
- •48. Понятие фазы, фазового равновесия и превращения. Правила фаз Гиббса
- •49.Фазовый переход первого и второго рода. Диаграммы состояния. Тройная точка.
25. Статистический и термодинамический методы исследования.Давление газа с точки зрения мкт
Молекулярная физика и термодинамика — разделы физики, в которых изучаются макроскопические процессы в телах, связанные с огромным числом содержащихся в телах атомов и молекул. Для исследования этих процессов применяют два качественно различных и взаимно дополняющих друг друга метода: статистический (молекулярно-кинетический) и термодинамический. Первый лежит в основе молекулярной физики, второй — термодинамики.
Молекулярная физика — раздел физики, изучающий строение и свойства вещества исходя из молекулярно-кинетических представлений, основывающихся на том, что все тела состоят из молекул, находящихся в непрерывном хаотическом движении.
Термодинамика — раздел физики, изучающий общие свойства макроскопических систем, находящихся в состоянии термодинамического равновесия, и процессы перехода между этими состояниями.
Макроскопическое состояние (или макросостояние) — это состояние системы, характеризуемое небольшим числом величин давления Р, температуры Т, объема V и, быть может, еще нескольких других существенных характеристик.
![]()
Уравнение можно записать в виде:
![]()
![]()
Последнее уравнение называют объединённым газовым законом. Из него получаются законы Бойля — Мариотта, Шарля и Гей-Люссака:
![]() —
закон
Бойля — Мариотта.
—
закон
Бойля — Мариотта.
![]() —
закон
Гей-Люссака.
—
закон
Гей-Люссака.
![]() —
закон
Шарля
—
закон
Шарля
Давление газа с точки зрения молекулярно-кинетической теории
Давление - это явление когда частицы (молекулы) "давят" на сосуд (под действием внутренней энергии и теплового беспорядочного движения ударяются в стенки сосуда). Чем больше кинетическая энергия частицы тем больше сила удара об стенку приходящаяся на единицу площади, тем больше давление.
26. Уравнение состояния идеального газа
Идеальным газом называется газ, молекулы которого являются материальными точками, то есть расстояния между молекулами намного превосходят их размеры, а единственный вид их взаимодействий между собой - упругие механические столкновения.
Состояние
данной массы газа полностью определено,
если известны его давление, температура
и объем. Эти величины называют параметрами
состояния газа. Уравнение, связывающее
параметры состояния, называют уравнением
состояния.
Для произвольной массы газа состояние
газа описывается уравнением
Менделеева—Клапейрона: pV = mRT/M, где
р —
давление, V
— объем, m — масса,
М — молярная
масса, R
— универсальная газовая постоянная.
Физический смысл универсальной газовой
постоянной в том, что она показывает,
какую работу совершает один моль
идеального газа при изобарном расширении
при нагревании на 1 К (R = 8,31 ДжДмоль •
К)).
Уравнение
Менделеева—Клапейрона показывает, что
возможно одновременное изменение трех
параметров, характеризующих состояние
идеального газа. Однако многие процессы
в газах, происходящие в природе и
осуществляемые в технике, можно
рассматривать приближенно как процессы,
в которых изменяются лишь два параметра.
Особую роль в физике и технике играют
три процесса: изотермический, изохорный
и изобарный.
Изопроцессом
называют процесс, происходящий с данной
массой газа при одном постоянном
параметре — температуре, давлении или
объеме. Из уравнения состояния как
частные случаи получаются законы для
изопроцессов.
Изотермическим называют
процесс, протекающий при постоянной
температуре. Т
= const. Он
описывается законом
Бойля—Мариотта: pV = const.
Изохорным
называют процесс, протекающий при
постоянном объеме. Для него справедлив
закон Шарля:
V = const, p/T = const.
Изобарным
называют процесс, протекающий при
постоянном давлении. Уравнение этого
процесса имеет вид V/T
= const при р
= const и называется
законом
Гей-Люссака.
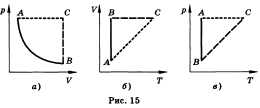
Все процессы можно изобразить графически
(рис. 15).
Реальные газы удовлетворяют уравнению
состояния идеального газа при не слишком
высоких давлениях (пока собственный
объем молекул пренебрежительно мал по
сравнению с объемом сосуда,
 в котором находится газ) и при не слишком
низких температурах (пока потенциальной
энергией межмолекулярного взаимодействия
можно пренебречь по сравнению с
кинетической энергией теплового движения
молекул), т. е. для реального газа это
уравнение и его следствия являются
хорошим приближением.
в котором находится газ) и при не слишком
низких температурах (пока потенциальной
энергией межмолекулярного взаимодействия
можно пренебречь по сравнению с
кинетической энергией теплового движения
молекул), т. е. для реального газа это
уравнение и его следствия являются
хорошим приближением.
