
- •41.Разбавленные растворы нелетучих веществ
- •42.Диаграмма кипения для бинарных систем
- •43.Идеальные газовые и жидкие растворы. Реальные растворы. Коэффициенты активности.
- •44.Растворы твердых веществ в жидкости
- •45.Характеристика растворов электролитов
- •46.Уравнение Вант-Гоффа,его термодинмический вывод. Осмотический коэффициент. Значение осмотических явлений в биологии.
- •47.Понятие о парциальных мольных величинах и методах их определения
- •48.Уравнение Гиббса-Дюгема.Взаимосвязи парциальных мольных велечин,активностей и коэффициентов активнстей,вытекающие из уравнения Гиббса-Дюгема
- •49.Термодинамика растворов электролитов
- •50.Основные положения теории электролитической диссоциации Аррениуса
- •51.Константа диссоциации слабого электролита
- •53.Теория Дебая-Хюккеля.Применение теории для среднего ионного коэффициента активности(1,2,3 приближение)
- •54.Удельная электропроводность и ее зависимость от концентрации для слабых и сильных электролитов
- •55.Эквивалентная электропроводность и ее зависимость от концентрации и рзведения
- •56.Закон Кольрауша(без вывода) и подвижность ионов
- •57.Понятие о числах переноса ионов
- •58.Электрохимический потенциал
- •59.Условия равновесия с участием заряженных частиц.Скачок потенциала на границе металл-раствор.Контактный и диффузионный потенциал
- •60.Схема и правила записи электрохимической цепи(гальванического элемента).Эдс.Электродные потенциалы.
53.Теория Дебая-Хюккеля.Применение теории для среднего ионного коэффициента активности(1,2,3 приближение)
Тео́рия си́льных электроли́тов Деба́я — Хю́ккеля — предложенная Петером Дебаем и Эрихом Хюккелем в 1923 году статистическая теория разбавленных растворов сильных электролитов, согласно которой каждый ион действием своего электрического заряда поляризует окружение и образует вокруг себя некоторое преобладание ионов противоположного знака — так называемую ионную атмосферу.В отсутствие внешнего электрического поля ионная атмосфера имеет сферическую симметрию, и её заряд равен по величине и противоположен по знаку заряду создающего её центрального иона. В этой теории не уделено почти никакого внимания образованию пар противоположно заряженных ионов путём непосредственного взаимодействия между ними.
Дебая-Хюккеля теория широко используют для расчета коэф. активности ионов в разбавленных растворах и концентрац. зависимости осмотич. коэффициентов. В первом приближении теория удовлетворительно описывает свойства растворов 1,1-валентных электролитов в области концентраций до 0,01 М, а для др. электролитов и неводных растворов - в меньшем диапазоне концентраций. Введение поправок, учитывающих конечный размер ионов (второе приближение) и уменьшение e вблизи ионов (третье приближение), позволяет применять Дебая-Хюккеля теорию в более широком диапазоне концентраций; для водных растворов 1,1-валентных электролитов - до 0,1 М. Ур-ние для расчета коэф. активности в третьем приближении Дебая-Хюккеля теории имеет вид:
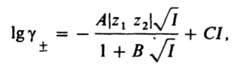
где В и С - эмпирич. постоянные. Ограниченность Дебая-Хюккеля теории обусловлена пренебрежением ассоциаций ионов, представлением о растворителе как о непрерывной среде, характеризуемой только значением e, т. е. неучетом мол. структуры растворителя и его взаимод. с ионами.
54.Удельная электропроводность и ее зависимость от концентрации для слабых и сильных электролитов
Удельной
электропроводностью называется
электропроводность раствора, заключенного
между электродами с поперечным сечением
в 1см2 и
находящимися на расстоянии 1 см друг
от друга. Удельная электропроводность χ (каппа)
равна величине, обратной удельному
сопротивлению ![]() ,
т.е. сопротивлению 1см3 проводника:
,
т.е. сопротивлению 1см3 проводника:
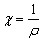 [ом-1 см-1 ]
[ом-1 см-1 ]
Удельная электропроводность слабых электролитов с повышением концентрации растет незначительно. Несмотря на общее повышение концентрации электролита концентрация ионов в растворе повышается мало, вследствие уменьшения степени диссоциации. Поэтому с повышением концентрации слабого электролита удельная электропроводность раствора медленно возрастает, достигает максимума, а затем уменьшается. Для сильных электролитов удельная электропроводность тем выше, чем больше концентрация ионов и чем больше их абсолютные скорости движения.
55.Эквивалентная электропроводность и ее зависимость от концентрации и рзведения
Эквивалентной электропроводностью называется электропро-водность раствора, заключенного между электродами, находящимися на расстоянии 1 см друг от друга и с такой большой поверхностью, что между электродами помещается раствор, содержащий 1 г-экв растворенного вещества.
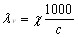 [ом-1•см2/2 – экв]
[ом-1•см2/2 – экв]
где С – концентрация раствора в г-экв/л.
Увеличение электропроводности с ростом температуры связано в основном с уменьшением вязкости раствора электролита. Обычно при повышении температуры на 1 К электропроводность увеличивается на 1,5 – 2%. Эквивалентная электропроводность растворов электролитов с разбавлением возрастает и в области предельных разбавлений достигает предельного значения λ∞, называемой электропроводностью при бесконечном разбавлении или предельной электропроводностью. Эта величина соответствует электропроводности гипотетически бесконечно разбавленного раствора, характеризующегося полной диссоциацией электролита и отсутствием сил электростатического взаимодействия между ионами. Для сильных электролитов зависимость эквивалентной электропроводности от концентрации выражается эмпирическим уравнением Кольрауша
![]()
где а – постоянная, зависящая от природы электролита, растворителя и температуры.
