
- •41.Разбавленные растворы нелетучих веществ
- •42.Диаграмма кипения для бинарных систем
- •43.Идеальные газовые и жидкие растворы. Реальные растворы. Коэффициенты активности.
- •44.Растворы твердых веществ в жидкости
- •45.Характеристика растворов электролитов
- •46.Уравнение Вант-Гоффа,его термодинмический вывод. Осмотический коэффициент. Значение осмотических явлений в биологии.
- •47.Понятие о парциальных мольных величинах и методах их определения
- •48.Уравнение Гиббса-Дюгема.Взаимосвязи парциальных мольных велечин,активностей и коэффициентов активнстей,вытекающие из уравнения Гиббса-Дюгема
- •49.Термодинамика растворов электролитов
- •50.Основные положения теории электролитической диссоциации Аррениуса
- •51.Константа диссоциации слабого электролита
- •53.Теория Дебая-Хюккеля.Применение теории для среднего ионного коэффициента активности(1,2,3 приближение)
- •54.Удельная электропроводность и ее зависимость от концентрации для слабых и сильных электролитов
- •55.Эквивалентная электропроводность и ее зависимость от концентрации и рзведения
- •56.Закон Кольрауша(без вывода) и подвижность ионов
- •57.Понятие о числах переноса ионов
- •58.Электрохимический потенциал
- •59.Условия равновесия с участием заряженных частиц.Скачок потенциала на границе металл-раствор.Контактный и диффузионный потенциал
- •60.Схема и правила записи электрохимической цепи(гальванического элемента).Эдс.Электродные потенциалы.
41.Разбавленные растворы нелетучих веществ
Особенностью такого раствора является то, что молекулы растворённого вещества отделены друг от друга большим числом молекул растворителя. Поэтому имеет место только взаимодействие между растворенным веществом и растворителем, но не между молекулами растворенного вещества. Вследствие этого, если к разбавленному раствору при постоянной температуре добавлять растворитель, то при разбавлении раствора с увеличением его объема не будет изменяться ни энергия U, ни энтальпия Н системы раствор - растворитель:(∂U/∂V)T = ∂(H/∂V)T = 0. Над разбавленными растворами нелетучих веществ давление насыщенного пара равно давлению пара растворителя р1.
42.Диаграмма кипения для бинарных систем
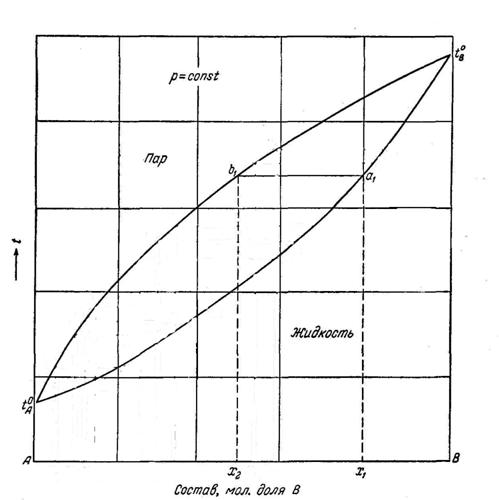
43.Идеальные газовые и жидкие растворы. Реальные растворы. Коэффициенты активности.
Растворы - однородная многокомпонентная система, состоящая из растворителя,
растворённых веществ и продуктов их взаимодействия, относительные количества
которых могут изменяться в широких пределах. Этот термин может относиться к
любому агрегатному состоянию системы. По агрегатному состоянию растворы могут
быть жидкими (морская вода), газообразными (смеси азота с аммиаком)
Реальные растворы в подавляющем большинстве не подчиняются законам идеальных растворов. Очень многие из них не подчиняются, например, закону Рауля, причем известны как положительные, так и отрицательные отклонения. Если давление пара над реальным раствором больше, чем над идеальным такого же состава, то отклонения от закона Рауля называют положительными, а если меньше, то отрицательными. Знак и величина отклонения зависит от природы растворителя и растворенного вещества. . Если молекулы одного компонента сильнее притягиваются друг к другу, чем к молекулам другого компонента, то парциальные давления пара над смесью будут больше вычисленных. Если же
частицы разных компонентов притягиваются друг к другу сильнее, чем частицы одного и того же компонента, то парциальные давления будут меньше вычисленных. В реальных растворах взаимодействия между однородными и разнородными молекулами различны. Если раствор образуется из частных компонентов А и В, то изменение потенциальной энергии при образовании раствора равно:
(U=[pic], где UA-A, UB-B и UA-B - средние потенциальные энергии взаимодействия между однородными и разнородными молекулами соответственно, если (U=0, то раствор идеальный. Идеальные растворы при всех концентрациях и температурах подчиняются закону Рауля.
Закон Рауля:
Относительное понижение парциального давления насыщенного пара растворителя над раствором равно молярной доле растворенного нелутучего вества:
(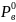 -
-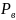 )/
)/ =
=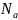 где
где
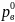 и
-давление насыщенного пара над чистым
растворителем и над раствором
соответственно
и
-давление насыщенного пара над чистым
растворителем и над раствором
соответственно
Отношение
активности (![]() )
к общей концентрации вещества в растворе
называется коэффициентом
активности:
)
к общей концентрации вещества в растворе
называется коэффициентом
активности:
![]()
Коэффициент активности служит мерой отклонения поведения раствора (или компонента раствора) от идеального.
