
- •41.Разбавленные растворы нелетучих веществ
- •42.Диаграмма кипения для бинарных систем
- •43.Идеальные газовые и жидкие растворы. Реальные растворы. Коэффициенты активности.
- •44.Растворы твердых веществ в жидкости
- •45.Характеристика растворов электролитов
- •46.Уравнение Вант-Гоффа,его термодинмический вывод. Осмотический коэффициент. Значение осмотических явлений в биологии.
- •47.Понятие о парциальных мольных величинах и методах их определения
- •48.Уравнение Гиббса-Дюгема.Взаимосвязи парциальных мольных велечин,активностей и коэффициентов активнстей,вытекающие из уравнения Гиббса-Дюгема
- •49.Термодинамика растворов электролитов
- •50.Основные положения теории электролитической диссоциации Аррениуса
- •51.Константа диссоциации слабого электролита
- •53.Теория Дебая-Хюккеля.Применение теории для среднего ионного коэффициента активности(1,2,3 приближение)
- •54.Удельная электропроводность и ее зависимость от концентрации для слабых и сильных электролитов
- •55.Эквивалентная электропроводность и ее зависимость от концентрации и рзведения
- •56.Закон Кольрауша(без вывода) и подвижность ионов
- •57.Понятие о числах переноса ионов
- •58.Электрохимический потенциал
- •59.Условия равновесия с участием заряженных частиц.Скачок потенциала на границе металл-раствор.Контактный и диффузионный потенциал
- •60.Схема и правила записи электрохимической цепи(гальванического элемента).Эдс.Электродные потенциалы.
49.Термодинамика растворов электролитов
Термодинамические уравнения для растворов электролитов подобны соответствующим уравнениям для неэлектролитов: различие заключается в том, что в отличие от неэлектролитов последние проводят электрический ток, а все виды частиц раствора электролита следует рассматривать как самостоятельные компоненты. В сильных электролитах это ионы всех сортов и молекулы растворителя, в слабых электролитах - еще и непродиссо-циированные молекулы растворенного вещества. Для растворов электролитов вводится дополнительное условие, по которому концентрации электрически заряженных частиц в равновесных гомогенных системах связаны между собой условием электронейтральности
?????????????????????????????????????????????????????
50.Основные положения теории электролитической диссоциации Аррениуса
1 Соли, кислоты и основания при растворении в воде и некоторых других полярных растворителях диссоциируют на ионы.2 Ионы существуют в растворе независимо от того, проходит через раствор электрический ток или нет. Вследствие этого число независимо движущихся частиц растворенного вещества больше, чем при отсутствии диссоциации, и коллигативные свойства электролитов возрастают в i раз.3 Процесс диссоциации описывается законом действующих масс (протекает обратимо). При уменьшении концентрации диссоциация становится практически полной4 Коэффициент Вант-Гоффа i – изотонический коэффициент – связан со степенью электролитической диссоциации.
51.Константа диссоциации слабого электролита
Для более точной оценки силы слабых электролитов служит константа электролитической диссоциации (Кд). Константа диссоциации Кдхарактеризует способность данного электролита в среде данного растворителя распадаться на ионы. Чем выше ее значение, тем больше концентрация ионов в сравнении с концентрацией нераспавшихся на ионы молекул электролита.В общем виде для процесса электролитической диссоциации, выражаемого уравнением:
KmAn ↔ mKn+ + nAm-
константа диссоциации равна:
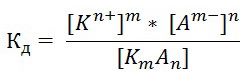
Значение константы диссоциации зависит от природы электролита, природы растворителя, температуры и не зависит от концентрации раствора. Данное свойство константы диссоциации позволяет определять силу слабых электролитов, пользуясь табличными значениями Кд. Чем больше константа диссоциации кислоты (основания), тем сильнее кислота (основание).
52.Активность и коэффициент активности электролита и иона. Средняя ионная активность и средний ионный коэффициент активности. Ионная сила раствора. Стандартное состояние растворенного электролита и растворителя.
Различают активность
электролита и активность
ионов.
Связь
активности электролита с активностями
ионов выражается следующим соотношением:
а= Экспериментальных
методов определения активности отдельных
ионов (а+ и а–)
не существует. Поэтому было введено
понятие средней
ионной активности (
Экспериментальных
методов определения активности отдельных
ионов (а+ и а–)
не существует. Поэтому было введено
понятие средней
ионной активности (![]() ),
представляющей собой среднее
геометрическое из активности отдельных
ионов
),
представляющей собой среднее
геометрическое из активности отдельных
ионов
Известно, что до ионной силы 0,01М коэффициент активности ( ƒ ) хорошо описывается расширенной формулой Дебая-Хюккеля:
|
(1) |
где z - заряд иона; I - ионная сила раствора; P - параметр Килланда, зависящий от размера иона; A = 0,509 при 250С ; B = 0,328 при 250С .
Ионная сила раствора равна
|
(2) |
где Ci - концентрация ионов одного вида в исследуемом растворе.
Для области большей ионной силы, самой распространенной является следующая формула:
|
Ионная сила раствора — мера интенсивности электрического поля, создаваемого ионами в растворе. Полусумма произведений из концентрации всех ионов в растворе на квадрат их заряда.
В
качестве стандартного состояния компонентов
в растворы электролитов выбирают:
для растворителя-состояние чистой
жидкости, для растворенного вещества-состояние
в гипотетич. растворе, где его
концентрация и активность
равны единице, а термодинамич.
свойства ![]() ,
, ![]() ,
, ![]() равны
соответствующим значениям для бесконечно
разб. раствора.
равны
соответствующим значениям для бесконечно
разб. раствора.


 .
.