
Применение
В хим. промыш. хлористый метил и хлористый этил применяются как алкилирующие средства, для наполнения манометрических термометров, в медицине - для кратковременного наркоза и для местной анастезии (обезболивания), как хладагент (в последнее время вытеснен менее токсичным и более экологически безвредными веществами), как интермедиат в производстве фармацевтических препаратов.
№8
Спирты - органические соединения, содержащие одну или более гидроксильных групп (гидроксил, −OH), непосредственно связанных с насыщенным (находящемся в состоянии sp³ гибридизации) атомом углерода. Спирты можно рассматривать как производные воды (H−O−H), в которых один атом водорода замещен на органическую функциональную группу: R−O−H.
Систематическая номенклатура.
Названия простых спиртов образуются от названий соответствующих алканов с добавлением суффикса «-ол», положение которого указывается арабской цифрой.
Для многоатомных спиртов перед суффиксом -ол по-гречески (-ди-, -три-, …) указывается количество гидроксильных групп (например: пропан-1,2,3-триол).
Рациональная и тривиальная номенклатура
Спирты, даже в научной литературе, часто называются по правилам, отличным от современной номенклатуры ИЮПАК. Очень распространённым является образование названия, как производного от соответствующего алкана, преобразованного в прилагательное с добавлением слова спирт:
этан С2Н6 → этиловый спирт C2H5OH;
гексан С6Н14 → гексиловый спирт C6H13OH.
Рациональная номенклатура спиртов рассматривает их как производные метанола CH3OH или по другому карбинола:
(СH3)2CНOH → диметилкарбинол;
(С6H5)3COH → трифенилкарбинол.
Общие химические методы получения спиртов
Спирты могут быть получены из самых разных классов соединений, таких как углеводороды, алкилгалогениды, амины, карбонильные соединения, эпоксиды. Существует множество методов получения спиртов, среди которых выделим наиболее общие:
реакции окисления — основаны на окислении углеводородов (реже — галогенпроизводных углеводородов), содержащих кратные или активированные C−H связи;

реакции восстановления — восстановление карбонильных соединений: альдегидов, кетонов, карбоновых кислот и сложных эфиров;
Для
восстановления альдегидов или кетонов,
обычно, пользуются борогидридом натрия
или калия, а также алюмогидридом лития
в протонном растворителе.
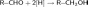
реакции гидратации — кислотно-катализируемое присоединение воды к алкенам (гидратация);

реакции присоединения:
присоединение синтез-газа, формальдегида, оксирана по кратным углеводородным связям;
Простейший пример такой реакции — промышленный синтез метанола
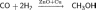
реакции замещения (гидролиза) — реакции нуклеофильного замещения, при которых имеющиеся функциональные группы замещаются на гидроксильную группу;
На практике для реакций замещения, как правило, используются галогенпроизводные:
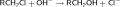
Химические свойства спиртов
Все химические реакции спиртов можно разделить на три условных группы, связанные с определёнными реакционными центрами и химическими связями:
Разрыв связи O−H (реакционный центр — водород)
Разрыв или присоединение по связи С−OH (реакционный центр — кислород)
Разрыв связи −СOH (реакционный центр — углерод)
Образование алкоголятов
Спирты ведут себя как слабые кислоты, вступая в реакцию по связи O−H со щелочными и некоторыми другими металлами, и с сильными основаниями, например:
2 R−OH + 2 Na → 2 R−O−Na+ + H2↑
Применение:
В парфюмерно-косметической промышленности и производстве отдушек для бытовой химии и прочей потребительской продукции, в пищевой промышленности, широко используемых в кулинарии, спирты можно встретить среди самых разных пищевых добавок, многие спирты используются в фармацевтическом производстве.
Физ св-ва и строение.
Подобно воде, спирты имеют существенно более высокие температуры плавления и кипения, чем можно было бы предполагать на основании физических свойств родственных соединений.
Так, из ряда монозамещённых производных метана, метанол имеет необычно высокую температуру кипения, несмотря на относительно небольшую молекулярную массу
Этот феномен объясняется наличием в спиртах водородных связей
Энергия разрыва водородной связи значительно меньше, чем обычной химической связи, но тем не менее, она существенным образом влияет на физические свойства спиртов.
Следует отметить, что влияние гидроксильной группы особенно велико на соединения с небольшой углеводородной цепочкой. Так, например, метанол и этанол неограниченно смешиваются с водой и имеют довольно высокие плотности и температуры кипения для своей молекулярной массы, в то время как высшие спирты гидрофобны и мало отличаются по свойствам от соответствующих углеводородов
