
№1
Алканы и Циклоалканы.
Алканы – алифатические углеводороды, в которых все валентности, не затраченные на образование простых связей С-С, насыщены атомами Н.
Гипотеза гибридизации (sp3-гибридизация) – при образовании молекулы метана и молекул др. соединений, в которых атомы углерода связаны одинарными сигма-связями, одна s- и 3 р-орбитали взаимодействуют между собой, образуя 4 новые равноценные орбитали.
Гомологическая разность – совокупность соединений, молекулы которых имеют сход. Строение и св-ва и отлич. На 1 или неск. групп –СН2-
СnH2n+2
Номенклатура.
По номенклатуре ИЮПАК названия алканов образуются при помощи суффикса -ан путём добавления к соответствующему корню от названия углеводорода. Выбирается наиболее длинная неразветвлённая углеводородная цепь так, чтобы у наибольшего числа заместителей был минимальный номер в цепи. В названии соединения цифрой указывают номер углеродного атома, при котором находится замещающая группа или гетероатом, затем название группы или гетероатома и название главной цепи. Если группы повторяются, то перечисляют цифры, указывающие их положение, а число одинаковых групп указывают приставками ди-, три-, тетра-. Если группы неодинаковые, то их названия перечисляются в алфавитном порядке.
Физ. св-ва. При норм.усл. первые 4 гомолог. Ряда (С1-С4) – газы без цвета и запаха. Алканы неразветвлённого строения (С5-С17) – бесцв. Жидкости с запахом бензина. Алканы с С18 – тв. в-ва белого цвета, жирные на ощупь. Чем больше число атомов С в цепи, тем больше t0кип.,плав. и плотность алканов. Газообразные и жидкие алканы образуют взрывоопасную смесь с воздухом. Жид. и тв. алканы легко смешиваются др. с др.
Получение: из нефти и природ. газа; гидрирование непред. углеводородов,углерода; взаимодействие смеси оксида С(II) с Н. Крекинг – процесс гомологич. разрыва связей С-С, который протек. при нагревании орг. в-ва без доступа воздуха в присутствии/отсутствии катализатора.
Хим. Cв-ва. При обыч. усл химически инертны. При норм. темп. устойчивы к реагентам. Хим.устойчивость определяется выс. прочностью сигма-связей С-С и С-Н, их низ. Полярностью и малой поляризуемостью. Р-ции радикального замещения, каталитического окисления, галогенирование, все алканы горят, нитрирование по Коновалову, пиролиз, дегидрирование, изомеризация, конверсия метана.
Применение. Топливо, в парфюмерии, медицине, технике, в хим. пром. получают сажу для производ. типографич. красок…
Циклоалканы – пред. Углеводороды, содержащ. замкнут. цепь углерод. атомов. Соединения: циклопропан, циклобутан, циклопентан, циклогексан. СтН2т. Молекула циклогексана содержит на 2 атома Н меньше, чем молекула алкана. Все атомы в циклоалканах в состоянии sp3-гибридизации, поэтому эти соединения относят к предельным углеводородам. На св-ва этих соед. оказ. влияние устойч-сть цикла, связанная с его размером. Изомерия углеродного скелета. В циклоалканах невозможно свобод. вращ. относительно связей С-С в цикле.
Названия циклоалканов образуют добавлением префикса цикло- к названию соответствующего неразветвлённого предельного углеводорода с тем же числом углеродных атомов.
Заместители же нумеруются в соответствии с их положением в цикле таким образом, чтобы сумма чисел в названии вещества была минимальной.
Физ. св-ва. С3 и С4 при обыч. усл. – газообразные, С5 и С6 – жидкости. Нафтеновые углеводороды почти не растворимы в воде, их t кип и плав. выше, чем у алканов.
Получение впервые были выведены из нефти и изучены Морковниковым В.В. Внутримолекулярная р-ция Вюрца; при каталитич. гидрировании ароматич. углеводород.
Хим. Св-ва существование углового напряжения циклопропане и циклобутане приводит к тому, что их св-ва существенно отличаются от св-в нафтенов со сред. размером цикла. Циклопентан и циклогексан лизки к алканам. Они легко вступают в реакции замещения. Присоединение галогенов и галогенводородов происход. труднее, чем с алкенами.
Применение. Практич. значение им. циклогексан, метилгексан и др. В процессе ароматизации нефти эти соединения превращ. в бензол, тоулол и др. в-ва, для синтеза красителей, медикаментов и т.д. Циклопропан прим. в медиц. в качестве наркоза.
№2
Алкены и алкадиены.
Непредельные соединения – углеводороды, содержащие в углеродной цепи 1 или неск. кратных углерод-углеродных связей.
Алкены(этиленовые) – непред. углеводороды, молекулы которых содержат 1 двойную углерод-углеродную С-С СnH2n
Изомерия: углерод. скелета, положение двойной связи, пространственная.
Физ. св-ва: При обыч. усл. С2-С4 – газ. в-ва без цвета и запаха, С5-С15 – бесцв. жидкости, С16 – тв. в-ва. Нерастворимы в воде, но раств. в орг. соединениях. Газообразные алкены образуют с воздухом взрывоопасные смеси. Низкие t кип. и плав.
Получение. В природе нет. Способ получения этиленовых углеводородов основан на превращении алканов в алкены с использованием природ. источников углеводородов. Крекинг алканов, дегидрирование алканов, дегидратация предельных одноатом. спиртов, дегалогенирование дигалогеналканов.
Хим. Cв-ва. Р-ция присоединения, гидрогалогенирование, гидратация, галогенирование, гидрирование, р-ция окисления, р-ция полимеризации.
Алкадиены (диеновые) – углеводороды, в молекулах которых содержатся 2 двойные связи С=С. СnH2n-2
Получение: дегидрирование алканов, р-ция Лебедева.
Cв-ва: лёгкость протекания р-ций присоед., окисл., полимеризации обусловлена наличием в молекуле алкадиенов 2 двойных связей. В результате полимеризации получаются синтетич. каучуки.
Применение. Для различного вида каучуков: дивинилового, изопренового, хлоропренового, бутадиен-стирольного и др.
№3
Алкины.
Алкины (непред. УВ ряда ацетилена) – содерж. тройную связь. Сn H2n-2. Атомы углерода при тройной связи наход. в состоян. sp-гибридизации.
Номенклатура.
Простейшим алкином явл. этин (ацетилен C2H2). По номенклатуре IUPAC названия алкинов образ. от названий соответствующих алканов заменой суффикса «-ан» на «-ин»; положение тройной связи указ. арабскими цифрами.
Углеводородные радикалы, образов. от алкинов, им. суф. «-инил», так CH≡C- называется «этинил».
Гомолог. ряд алкинов:
Этин: C2H2, Пропин: C3H4, Бутин: C4H6, Пентин: C5H8, Гексин: C6H10, Гептин: C7H12, Октин: C8H14, Нонин: C9H16, Децин: C10H18
Физ. св-ва.
Алкины по своим физ. св-вам напоминают соответствующие алкены. Низшие (до С4) — газы без цвета и запаха, имеющие более высокие темп. кипения, чем аналоги в алкенах. Алкины плохо раств. в воде, лучше — в орг. растворителях.
Хим. св-ва.
Для алкинов характерны р-ции присоед. В отличие от алкенов, которым свойст. р-ции электрофильного присоед., алкины могут вступ. и в р-кции нуклеофильного присоед. Это обусловлено значительным s-характером связи и, как следствие, повыш. электроотрицательностью атома углерода. Кроме того, больш. подвижность атома Н при тройной связи обуславливает кислот. св-ва алкинов в р-циях замещ.
Качественная реакция.
Р-ция алкинов с аммиакатами серебра или одновалентной Сu явл. качественной на наличие тройной связи
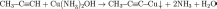
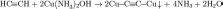
Нахождение в природе.
В природе алкины не встреч. В некот. видах грибов Basidiomycetes были обнаруж. в крайне малом кол-ве соединения, содержащие полиацетиленовые структуры.
Ацетилен обнаруж. в атмосфере Урана, Юпитера и Сатурна.
Алкины облад. слаб. наркоз. действием. Жид. алкины выз. судороги.
Применение.
Из всех ацетиленовых УВ серьёзное промыш. знач. им. только ацетилен, кот. явл. важнейшим хим. сырьём.
При горении ацетилена выделяется много тепла, что используется для резки и сварки металлов в ацетилен-кислородной сварке (расходуется до 30 % всего производимого ацетилена).
В конце 19-го — начале 20-го века шир. популярностью польз. многочисленные ацетиленовые светильники (источником ацетилена служил дешевый карбид кальция), используемые на железнодорожном и вод. транспорте, для освещ. улиц, в быту.
Получение.
Осн. Промыш. способ. Получ. ацетилена явл. электро- или термокрекинг метана, пиролиз природ. газа и карбидный метод.
Карбидный метод (промышленный способ). Прокаливанием в электрических печах смеси оксида кальция с коксом при 1800—2000°С получ. карбид кальция:
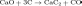
При действии на полученный карбид воды образуется гидроксид кальция и ацетилен:
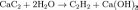
Пиролиз УВ (промышленный способ) Суть способа заключ. в пропускании над спец. огнеупорной насадкой смеси природ. газа с воздухом, который, сгорая, подним. темп. до 1500 °C. Затем на насадке происходит пиролиз метана.
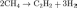
Крекинг природного газа (промышленный способ Электрокрекинг Метод заключ. в пропускании метана между двумя металлическими электродами с огромной скоростью. Температура 1500—1600°С. С хим. точки зрения метод аналогичен методу пиролиза, отличаясь лишь технологическим и аппаратным исполнением.
Термоокислительный крекинг.В этом методе использ. Частич. окисление метана благодаря использованию теплоты, образующейся при его сгорании.
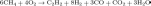
Метод прямого синтеза Углерод напрямую взаим. с Н при очень выс. темп-х:

№4
Ароматическими соединениями обычно называют карбоциклические соединения, в молекулах которых имеется особая циклическая группировка из шести углеродных атомов – бензольное ядро. Простейшим веществом является углеводород бензол; все остальные ароматические соединения этого типа рассматривают как производные бензола.
Благодаря наличию в ароматических соединениях бензольного ядра они по некоторым свойствам значительно отличаются от предельных и непредельных алициклических соединений, а также и от соединений с открытой цепью. Отличительные свойства ароматических веществ, обусловленные наличием в них бензольного ядра, обычно называют ароматическими свойствами, а бензольное ядро – соответственно ароматическим ядром.
Физические свойства.
Бензол и его простейшие гомологи – бесцветные жидкости с характерными запахами, не смешивающиеся с водой. Некоторые высшие гомологи – твердые вещества. Температуры кипения и плавления ароматических углеводородов зависят от величины и изомерии боковых целей, а также от взаимного положения их в бензольном ядре.
Химические свойства
Бензол, несмотря на то, что по составу он является ненасыщенным соединением, проявляет склонность преимущественно к реакциям замещения, и бензольное ядро очень устойчиво. В этом заключаются свойства бензола, которые называют ароматическими свойствами. Последние характерны и для других ароматических соединений; однако различные заместители в бензольном ядре влияют на его устойчивость и реакционную способность; в свою очередь бензольное ядро оказывает влияние на реакционную способность соединенных с ним заместителей. Рассмотрим следующие группы реакций ароматических углеводородов : а) реакции замещения, б) реакции присоединения в) действие окислителей.
