
- •4.3 Окислительно-восстановительные реакции
- •4.3.1 Общие сведения об окислительно-восстановительных реакциях
- •Если в формуле (6.1 а) не использовать множитель 100%, то массовая доля будет выражена не в процентах, а в долях единицы.
- •2.1 Зависимость скорости реакции от природы реагирующих веществ
- •2.2 Зависимость скорости реакции от концентрации реагирующих веществ
- •2.3 Зависимостьскорости реакции от температуры
- •2.4 Зависимость скорости реакции от присутствия катализаторов.
- •1. Тривиальная номенклатура
- •4. Радикало-функциональная номенклатура
- •2. Физические свойства спиртов
- •3. Одноатомные предельные спирты.
- •3.1 Методы получения
- •3.2 Химические свойства предельных спиртов
- •4. Двухатомные и трехатомные спирты. Методы получения и химические свойства.
- •5. Фенолы. Общая характеристика. Методы получения и химические свойства.
- •6. Отдельные представители. Методы идентификации.
- •Общая характеристика: строение, классификация, номенклатура
- •2. Способы получения аминов
- •3. Физические свойства аминов
- •4. Химические свойства аминов
- •2. Физические свойства альдегидов и кетонов
- •3. Способы получения
- •4. Химические свойства
- •1 Общая характеристика (строение, классификация, номенклатура, изомерия).
- •Классификация и номенклатура аминокислот.
- •5. С анионобразующими группами в боковых цепях-аспарагиновая и глутаминовая кислоты:
- •Физико-химические свойства аминокислот.
- •Химические реакции аминокислот.
- •Общая характеристика: строение, и свойства белков
- •1.1 Строение белковой молекулы
- •Физико-химические свойства белков.
- •Классификация белков
- •Мальтоза
- •Целлобиоза
- •Лактоза
- •Сахароза
- •Ферментативный гидролиз крахмала и гликогена
- •2. Физические свойства карбоновых кислот
- •3. Способы получения
- •4. Химические свойства
- •Общие признаки, функции, классификация
- •Жирные кислоты
- •Омыляемые липиды
- •Простые липиды
- •Прогоркание жира
- •Сложные липиды Фосфолипиды
- •Гликолипиды
- •Неомыляемые липиды
- •Стероиды
- •Терпены
6. Отдельные представители. Методы идентификации.
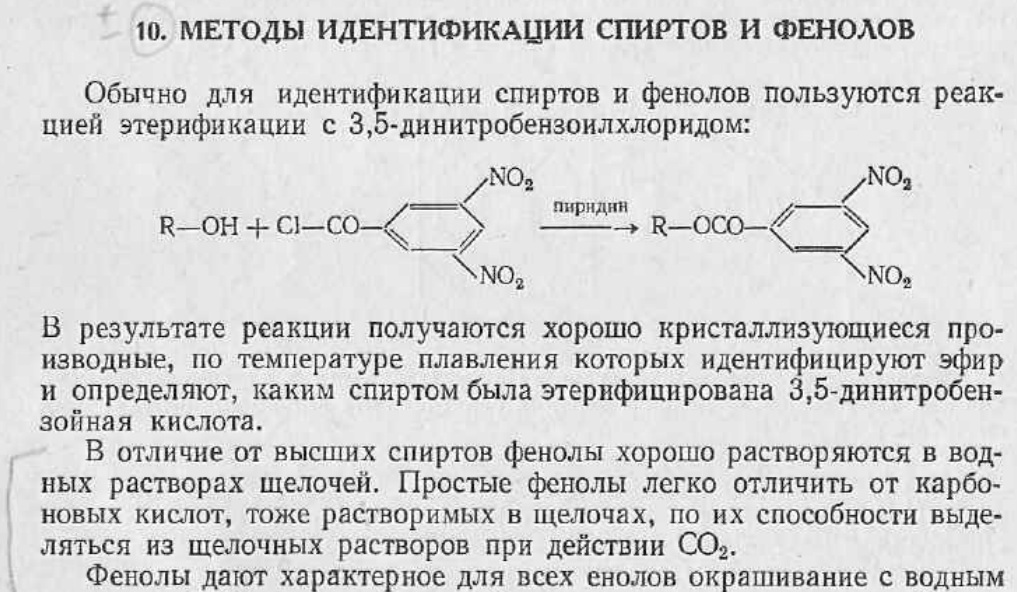





№22





Методы идентификации

Отдельные представители


№23
Общая характеристика: строение, классификация, номенклатура
Аминами называются производные аммиака, молекуле которого атомы водорода замещены на углеводородные радикалы.
Номенклатура, изомерия аминов
1. Названия аминов по рациональной номенклатуре обычно производят от названий входящих в них углеводородных радикалов с присоединением окончания –амин: метиламин СН3–NН2, диметиламин СН3–NН–СН3, триметиламин (СН3)3N, пропиламин СН3СН2СН2–NН2, фениламин С6Н5– NН2 и т. д.
2 .
По номенклатуре ИЮПАК аминогруппу
рассматривают как функциональную группу
и ее название амино-
ставят
перед названием основной цепи:
.
По номенклатуре ИЮПАК аминогруппу
рассматривают как функциональную группу
и ее название амино-
ставят
перед названием основной цепи:
Изомерия аминов зависит от изомерии радикалов.
2. Способы получения аминов
Амины могут быть получены различными способами.
А) Действием на аммиак галогеналкилами
2NH3 + CH3I –– CH3– NH2 + NH4I
Б) Каталитическое гидрирование нитробензола молекулярным водородом:
3Н2
С6Н5NО2 –– С6Н5NН2 + Н2О
нитробензол кат анилин
В) Получение низших аминов (С1–С4) путем алкилирования спиртами:
3500C, Al2O3
R–OH + NH3 ––––––––––– R–NH2 +H2O
3500C, Al2O3
2R–OH + NH3 ––––––––––– R2 –NH +2H2O
3500C, Al2O3
3R–OH + NH3 ––––––––––– R3–N + 3H2O
3. Физические свойства аминов
Метиламин, диметиламин и триметиламин — газы, средние члены ряда аминов — жидкости, высшие — твердые тела. С увеличением молекулярной массы аминов увеличивается их плотность, повышается температура кипения и уменьшается растворимость в воде. Высшие амины в воде нерастворимы. Низшие амины имеют неприятный запах, несколько напоминающий запах испорченной рыбы. Высшие амины или не имеют запаха, или обладают очень слабым запахом. Ароматические амины представляют собой бесцветные жидкости или твердые вещества, обладающие неприятным запахом и ядовиты.
4. Химические свойства аминов
Химическое поведение аминов определяется наличием в молекуле аминогруппы. На внешней электронной оболочке атома азота имеется 5 электронов. В молекуле амина также, как и в молекуле аммиака, атом азота затрачивает на образование трех ковалентных связей три электрона, а два остаются свободными.
Наличие свободной электронной пары у атома азота дает ему возможность присоединять протон, поэтому амины подобны аммиаку, проявляют основные свойства, образуют гидроксиды, соли.
С![]() олеобразование.
Амины
с кислотами дают соли, которые под
действием сильного основания вновь
дают свободные амины:
олеобразование.
Амины
с кислотами дают соли, которые под
действием сильного основания вновь
дают свободные амины:
А налогично
строению молекулы хлорида аммония
можно представить и строение солей
аминов:
налогично
строению молекулы хлорида аммония
можно представить и строение солей
аминов:
А![]() мины
дают соли даже со слабой угольной
кислотой:
мины
дают соли даже со слабой угольной
кислотой:
П рисоединение
алкилгалогенидов к третичным аминам
идет по той же схеме:
рисоединение
алкилгалогенидов к третичным аминам
идет по той же схеме:
К![]() ак
и аммиак, амины обладают основными
свойствами что объясняется связыванием
протонов в слабо диссоциирующий катион
замещенного аммония:
ак
и аммиак, амины обладают основными
свойствами что объясняется связыванием
протонов в слабо диссоциирующий катион
замещенного аммония:
При растворении амина в воде часть протонов воды расходуется на образование катиона; таким образом, в растворе появляется избыток гидроксид-ионов, и он имеет щелочные свойства, достаточные для окрашивания растворов лакмуса в синий цвет и фенолфталеина в малиновый. Основность аминов предельного ряда колеблется в очень небольших пределах и близка к основности аммиака.
Эффект метильных групп несколько повышает основность метил- и диметиламина. В случае триметиламина метильные группы уже затрудняют сольватацию образующегося катиона и уменьшают его стабилизацию, а следовательно, и основность.
Соли аминов следует рассматривать как комплексные соединения. Центральным атомом в них является атом азота, координационное число которого равно четырем. Атомы водорода или алкилы связаны с атомом азота и расположены во внутренней сфере; кислотный остаток расположен во внешней сфере.
А![]() цилирование
аминов.
При
действии на первичные и вторичные амины
некоторых производных органических
кислот (галогенангидридов, ангидридов
и др.) образуются амиды:
цилирование
аминов.
При
действии на первичные и вторичные амины
некоторых производных органических
кислот (галогенангидридов, ангидридов
и др.) образуются амиды:
Третичные амины в эту реакцию не вступают.
Действие на амины азотистой кислоты. Эта реакция имеет важное аналитическое значение, так как позволяет различать первичные, вторичные и третичные амины неароматического характера.
П![]() ри
действии азотистой кислоты на первичные
амины (кроме ароматических аминов)
выделяется свободный азот и образуется
чаще всего спирт:
ри
действии азотистой кислоты на первичные
амины (кроме ароматических аминов)
выделяется свободный азот и образуется
чаще всего спирт:
В торичные
амины с азотистой кислотой дают
нитрозоамины
—
желтоватые жидкости, мало растворимые
в воде:
торичные
амины с азотистой кислотой дают
нитрозоамины
—
желтоватые жидкости, мало растворимые
в воде:
П![]() ри
обработке крепкой соляной кислотой
нитрозоамины снова дают исходные амины:
ри
обработке крепкой соляной кислотой
нитрозоамины снова дают исходные амины:
Третичные амины устойчивы к действию разбавленной азотистой кислоты на холоду (образуют соли азотистой кислоты), в более жестких условиях один из радикалов отщепляется и образуется нитрозоамин.
Диамины
Диамины играют важную роль в биологических процессах. Как правило, они легко растворимы в воде, обладают характерным запахом, имеют сильно щелочную реакцию, взаимодействуют с С02 воздуха. Диамины образуют устойчивые соли с двумя эквивалентами кислоты.
Э![]() тилендиамин
(1,2-этандиамин)
H2NCH2СН2NН2.
Он является простейшим диамином; может
быть получен действием аммиака на
этиленбромид:
тилендиамин
(1,2-этандиамин)
H2NCH2СН2NН2.
Он является простейшим диамином; может
быть получен действием аммиака на
этиленбромид:
Тетраметилендиамин (1,4-бутандиамин), или путресцин, NН2СН2СН2СН2СН2NH2 и пентаметилендиамин (1,5-пентандиамин) NН2СН2СН2СН2СН2СН2NН2, или кадаверин. Они были открыты в продуктах разложения белковых веществ; образуются при декарбоксилировании диаминокислот и названы птомаинами (от греч. — труп), их считали ранее «трупными ядами». В настоящее время выяснено, что ядовитость гниющих белков вызвана не птомаинами, а присутствием других веществ.
Путресцин и кадаверин образуются в результате жизнедеятельности многих микроорганизмов (например, возбудителей столбняка и холеры) и грибков; они встречаются в сыре, спорынье, мухоморе, пивных дрожжах.
Некоторые диамины применяются в качестве сырья для получения полиамидных волокон и пластмасс. Так, из гекса-метилендиамина NН2СН2СН2СН2СН2СН2СН2NН2 получено весьма ценное синтетическое волокно — найлон (США) или анид (Россия).
Аминоспирты
Аминоспирты — соединения со смешанными функциями, в молекуле которых содержатся амино- и оксигруппы.
Аминоэтанол (этаноламин) НО—СН2СН2—NH2, или коламин.
Э таноламин
— густая маслянистая жидкость,
смешивается с водой во всех отношениях,
обладает сильными щелочными свойствами.
Hаряду
с моноэтаноламином получаются также
диэтаноламин и триэтаноламин:
таноламин
— густая маслянистая жидкость,
смешивается с водой во всех отношениях,
обладает сильными щелочными свойствами.
Hаряду
с моноэтаноламином получаются также
диэтаноламин и триэтаноламин:
Этаноламины широко применяются в технике в качестве эмульгаторов и других поверхностно-активных веществ, а также в различных процессах газоочистки, в том числе для извлечения оксида углерода (IV) из топочных газов при производстве сухого льда (твердой двуокиси углерода).
Х олин.
Он представляет собой четырехзамещенное
аммониевое основание. В нем с атомом
азота связаны три метильные и одна
окси-этильная группа:
олин.
Он представляет собой четырехзамещенное
аммониевое основание. В нем с атомом
азота связаны три метильные и одна
окси-этильная группа:
Холин входит в состав лецитинов — жироподобных веществ, весьма распространенных в животных и растительных организмах, и может быть выделен из них. Холин представляет собой кристаллическую, весьма гигроскопичную, легко расплывающуюся на воздухе массу. Он обладает сильными щелочными свойствами и с кислотами легко образует соли.
П ри
ацилировании холина уксусным ангидридом
образуется холинацетат,
называемый
также ацетилхолином:
ри
ацилировании холина уксусным ангидридом
образуется холинацетат,
называемый
также ацетилхолином:
Ацетилхолин играет крайне важную биохимическую роль, так как является медиатором (посредником), передающим возбуждение от нервных рецепторов к мышцам.


№24
Альдегидами и кетонами называются соединения, содержащие в молекуле оксо– или карбонильную группу:

Отсюда другое их название – карбонильные соединения. В молекуле альдегидов атом углерода карбонильной группы связан с углеводородным радикалом и атомом водорода:
|
|
В молекуле кетонов атом углерода карбонильной группы связан с двумя углеводородными радикалами:
|
|
Классификация
В зависимости от характера углеводородных радикалов, входящих в молекулу альдегидов и кетонов различают: предельные, непредельные, ароматические и др. Кетоны могут быть смешанного типа: радикалы с которыми связана кетогруппа, могут принадлежать к разным классам. По количеству карбонильных групп различают монокарбонильные, дикарбонильные и поликарбонильные соединения.
Альдегиды |
Кетоны |
|
|
|
|
|
|
|
Кетоны смешанного типа
|
Номенклатура. Изомерия.
Альдегиды часто называют по наименованию кислот, в которые они превращаются после окисления (уксусный альдегид). По рациональной (радикально-функциональной) при наименовании кетонов называют углеводородные радикалы и добавляют слово кетон (диметилкетон). По ИЮПАК в основе наименования альдегидов и кетонов лежит название углеводорода с тем же числом углеродных атомов, включая углеродный атом карбонильной группы. Для альдегидов добавляют окончание «-аль» (бутаналь), для кетонов – «-он» (пентанон). Нумерацию углеродной цепи начинают с того конца, к которому ближе расположен карбонильный углерод.
Изомерия альдегидов и кетонов определяется строением углеводородных радикалов.
Оксосоединения |
Изомеры |
|
|
|
|

















