
- •4.3 Окислительно-восстановительные реакции
- •4.3.1 Общие сведения об окислительно-восстановительных реакциях
- •Если в формуле (6.1 а) не использовать множитель 100%, то массовая доля будет выражена не в процентах, а в долях единицы.
- •2.1 Зависимость скорости реакции от природы реагирующих веществ
- •2.2 Зависимость скорости реакции от концентрации реагирующих веществ
- •2.3 Зависимостьскорости реакции от температуры
- •2.4 Зависимость скорости реакции от присутствия катализаторов.
- •1. Тривиальная номенклатура
- •4. Радикало-функциональная номенклатура
- •2. Физические свойства спиртов
- •3. Одноатомные предельные спирты.
- •3.1 Методы получения
- •3.2 Химические свойства предельных спиртов
- •4. Двухатомные и трехатомные спирты. Методы получения и химические свойства.
- •5. Фенолы. Общая характеристика. Методы получения и химические свойства.
- •6. Отдельные представители. Методы идентификации.
- •Общая характеристика: строение, классификация, номенклатура
- •2. Способы получения аминов
- •3. Физические свойства аминов
- •4. Химические свойства аминов
- •2. Физические свойства альдегидов и кетонов
- •3. Способы получения
- •4. Химические свойства
- •1 Общая характеристика (строение, классификация, номенклатура, изомерия).
- •Классификация и номенклатура аминокислот.
- •5. С анионобразующими группами в боковых цепях-аспарагиновая и глутаминовая кислоты:
- •Физико-химические свойства аминокислот.
- •Химические реакции аминокислот.
- •Общая характеристика: строение, и свойства белков
- •1.1 Строение белковой молекулы
- •Физико-химические свойства белков.
- •Классификация белков
- •Мальтоза
- •Целлобиоза
- •Лактоза
- •Сахароза
- •Ферментативный гидролиз крахмала и гликогена
- •2. Физические свойства карбоновых кислот
- •3. Способы получения
- •4. Химические свойства
- •Общие признаки, функции, классификация
- •Жирные кислоты
- •Омыляемые липиды
- •Простые липиды
- •Прогоркание жира
- •Сложные липиды Фосфолипиды
- •Гликолипиды
- •Неомыляемые липиды
- •Стероиды
- •Терпены
2. Физические свойства альдегидов и кетонов
Первый член гомологического ряда – предельных альдегидов – формальдегид, представляет собой при обычной температуре газ. Раствор формальдегида в воде (37-40%) называют формалином. Низшие альдегиды и кетоны (уксусный альдегид и ацетон) смешивается с водой во всех соотношениях, бензальдегид растворим в воде лишь около 3%. Формальдегид имеет острый , удушающий запах, бензальдегид имеет запах горького миндаля. Температура кипения низших членов ряда альдегидов и кетонов выше, чем у соответствующих углеводородов и ниже чем у соответствующих спиртов. Плотности у альдегидов и кетонов ниже единицы.
Высокомолекулярные альдегиды (С10 и С11) обладают приятным запахом, применяются в парфюмерии. Альдегиды и некоторые кетоны участвуют в формировании вкуса и аромата хлеба и вина и др. продуктов.
3. Способы получения




4. Химические свойства
Альдегиды и кетоны принадлежат к числу наиболее реакционноспособных органических соединений, причем альдегиды активнее кетонов. Высокая активность оксосоединений связана с наличием корбонильной группы и особенностями ее строения. В карбонильной группе связь между атомамиуглерода и кислорода осуществляется двумя парами электронов из – и -связей. Вследствии большой электроатрицательности кислорода электронная плотность смещена в сторону кислорода.








№25
1 Общая характеристика (строение, классификация, номенклатура, изомерия).
Основной структурной единицей белков являются -аминокислоты. В природе встречается примерно 300 аминокислот. В составе белков найдено 20 различных -аминокислот (одна из них – пролин, является не амино-, а иминокислотой). Все другие аминокислоты существуют в свободном состоянии или в составе коротких пептидов, или комплексов с другими органическими веществами.
-Аминокислоты представляют собой производные карбоновых кислот, у которых один водородный атом, у -углеродного атома замещен на аминогруппу (–NН2), например:

Различаются аминокислоты по строению и свойствам радикала R. Радикал может представлять остатки жирных кислот, ароматические кольца, гетероциклы. Благодаря этому каждая аминокислота наделена специфическими свойствами, определяющими химические, физические свойства и физиологические функции белков в организме.
Именно благодаря радикалам аминокислот, белки обладают рядом уникальных функций, не свойственных другим биополимером, и обладают химической индивидуальностью.
Значительно реже в живых организмах встречаются аминокислоты с - или -положением аминогруппы, например:
Изомерия
В молекулах всех природных аминокислот ( за исключением глицина) у -углеродного атома все четыре валентные связи заняты различными заместителями, такой атом углерода является асимметрическим, и получил название хирального атома. Вследствие этого растворы аминокислот обладают оптической активностью – вращают плоскость плоскополяризованного света. Число возможных стереоизомеров ровно 2n, где n – число асимметрических атомов углерода. У глицина n = 0, у треонина n = 2. Все остальные 17 белковых аминокислот содержат по одному асимметрическому атому углерода, они могут существовать в виде двух оптических изомеров.
В качестве стандарта при определении L и D-конфигураций аминокислот используется конфигурация стереоизомеров глицеринового альдегида.
Расположение в проекционной формуле Фишера NH2-группы слева соответствуют L-конфигурации, а справа – D-конфигурации.
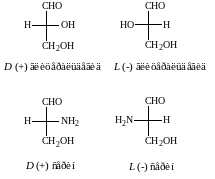
Следует отметить, что буквы L и D означают принадлежность того или иного вещества по своей стереохимической конфигурации к L или D ряду, независимо от направленности вращения.
В составе белков обнаруживаются только L-изомеры аминокислот. D-формы аминокислот в природе встречаются редко и обнаружены лишь в составе белков клеточной стенки (гликопротеинов) некоторых бактерий и в пептидных антибиотиках (грамицидин, актиномицин и т.д.). L-формы хорошо усваиваются растениями и животными и легко включаются в обменные процессы. D-формы не ассимилируются этими организмами, а иногда даже ингибируют процессы обмена. Это объясняется тем, что ферментативные системы организмов специфически приспособлены к L формам аминокислот.
Кроме 20 стандартных аминокислот встречающихся почти во всех белках, существуют еще нестандартные аминокислоты, являющиеся компонентами лишь некоторых типов белков – эти аминокислоты называют еще модифицированными (гидроксипролин и гидроксилизин).
