
- •- Кинетика хим. Реакций
- •- Комплексные соединения
- •- Водородная связь
- •- Влияние температуры на скорость хим. Реакций
- •Гомогенный катализ.
- •Гетерогенный катализ.
- •Билет 7. - понятие об энтропии
- •- Каталистический процесс
- •Билет 8. - понятие о термодинамике
- •Законы — начала термодинамики
- •- Хим. Связь (как она образуется)
- •Билет 9. - табл. Менделеева(строение эл-ов)
- •- Комплексные соединения и их строение
- •Следствия из закона Гесса
- •- Основные типы органических соединений
- •Применение
Гомогенный катализ.

Механизм действия катализаторов основан на теории промежуточных соединений (Н.Д.Зелинский, П.Сабатье). Согласно этой теории катализатор образует с реагирующими веществами промежуточные соединения. Энергия активации этого процесса меньше, чем энергия активации некаталитической реакции, что и ведет к увеличению скорости превращения.
Пусть имеются две реакции, протекающие с невысокой скоростью: A + B = AВ, CD = C + D. В присутствии катализатора К реакции протекают в две стадии: А + К = АК, CD + K = CDK, где АК и CDK являются промежуточными соединениями, образующими конечные продукты: АК + В = АВ + К , CDK = C + D + K. Гомогенными каталитическими реакциями являются ферментативные процессы, протекающие в живых организмах. Энергетическая схема реакции A + B = AB приведена на рис.3.3. Из рис.3.3 следует: 1) энергии активации каждой из промежуточных стадий меньше энергии активации некаталитической реакции Е*; 2) использование катализатора не изменяет энтальпию реакции ΔrH.
Гетерогенный катализ.
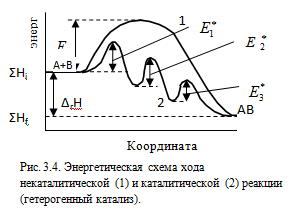
Исходной стадией гетерогенного катализа является адсорбция реагентов, т.е. связывание молекул реагирующих веществ с поверхностью другого вещества. Процесс адсорбции происходит в несколько стадий. Благодаря диффузии, молекулы реагирующих веществ подходят к поверхности, где происходит их адсорбция. Взаимодействие адсорбированных частиц реагентов с поверхностью катализатора ведет к увеличению их энергии. Процесс называется активированной адсорбцией, который протекает не на всей поверхности катализатора, а только на активных центрах (различные дефекты поверхности). Число активных центров определяет активность катализатора и зависит от способа приготовления катализатора и величины его поверхности. В результате активированной адсорбции изменяется электронная структура молекул реагентов, что ведет к снижению энергии активации и на поверхности катализатора протекает химическая реакция. Продукт химической реакции покидает поверхность катализатора, т.е. происходит десорбция и за счет диффузии переходит в окружающую среду.
Все три стадии – адсорбция, образование активированного комплекса и десорбция являются активационными процессами и характеризуются собственными энергиями активации. Скорость каталитической реакции возрастает, если энергии активации каждой из этих стадий будет ниже энергии активации соответствующей некаталитической реакции
Билет 7. - понятие об энтропии
Энтропи́я (от др.-греч. ἐντροπία - поворот, превращение) — в естественных науках мера беспорядка системы, состоящей из многих элементов. В частности, в статистической физике — мера вероятности осуществления какого-либо макроскопического состояния; в теории информации — мера неопределённости какого-либо опыта (испытания), который может иметь разные исходы, а значит, и количество информации; в исторической науке, для экспликации феномена альтернативности истории (инвариантности и вариативности исторического процесса).
Понятие энтропии впервые было введено Клаузиусом в термодинамике в 1865 году для определения меры необратимого рассеивания энергии, меры отклонения реального процесса от идеального. Определённая как сумма приведённых теплот, она является функцией состояния и остаётся постоянной при обратимых процессах, тогда как в необратимых — её изменение всегда положительно.
![]() ,
,
где
![]() —
приращение энтропии;
—
приращение энтропии;
![]() —
минимальная теплота, подведенная к
системе; T — абсолютная температура
процесса;
—
минимальная теплота, подведенная к
системе; T — абсолютная температура
процесса;
