
- •Современные представления о строении атома. Состояние электрона в атоме. Квантовые числа. Строение электронных оболочек атомов. Строение атома
- •Периодический закон и периодическая система д.И.Менделеева.
- •4. Природа химической связи. Типы химических связей: ионная, ковалентная, донорно-акцепторная, водородная.
- •5.Основные типы химических реакций. Классификация химических реакций.
- •6. Растворы. Характеристика растворов. Процесс растворения. Состав растворов. Свойства растворов. Способы количественного выражения состава растворов.
- •7.Химическое равновесие.Необратимые и обратимые реакции.
- •Понятие химического равновесия. Смещение химического равновесия. Принцип Ле-Шателье.
- •Основные положения химической кинетики. Понятие скорости химических реакций. Константа скорости.
- •Факторы, влияющие на скорость химических реакций.
- •Классификация электролитов. Ионное произведение воды. Водородный показатель. Буферные растворы. Реакции гидролиза.
- •Окислительно-восстановительные реакции. Понятие окисления, восстановления, окислитель, восстановитель.
- •Типы окислительно-востановительных реакций. Типичные окислители и восстановители. Составление уравнений окислительно-восстановительных реакций (метод электронного баланса, метод полуреакций).
- •Предмет органической химии. Исторический обзор развития органической химии. Первые теоретические воззрения. Теория строения а.М.Бутлерова.
- •Химические свойства атомов и атомных групп неизменны и меняются только под влиянием присутствующих атомов и атомных групп, особенно непосредственно связанных друг с другом.
- •16. Основы номенклатуры в органической химии. Классификация органических соединений.
- •4. Радикало-функциональная номенклатура
- •Углеводороды алифатического ряда (алкены). Общая характеристика: строение, изомерия, номенклатура. Физические и химические свойства. Методы получения и идентификации. Отдельные представители.
- •20.Ароматические углеводороды (арены). Общая характеристика: строение, изомерия, номенклатура. Физические и химические свойства. Методы получения и идентификации. Отдельные представители.
- •А)Гидрирование
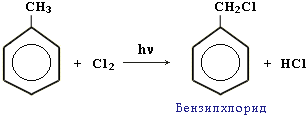
- •Б)Радикальное хлорирование
- •21.Спирты и фенолы. Общая характеристика: номенклатура и изомерия. Физические и химические свойства. Методы получения и идентификации. Отдельные представители
- •Изомерия
- •Электронное строение
- •Физические свойства
- •23.Простые эфиры и эфиры неорганических кислот. Общая характеристика: номенклатура и изомерия. Физические и химические свойства. Методы получения и идентификации. Отдельные представители.
- •24.Амины и аминоспирты. Общая характеристика: номенклатура и изомерия. Физические и химические свойства. Методы получения и идентификации.
- •25.Альдегиды и кетоны алифатического и ароматического ряда. Общая характеристика. Физические и химические свойства. Методы получения и идентификации. Отдельные представители.
- •1 Реакции присоединения
- •3 Реакция полимеризации
- •26.Аминокислоты. Общая характеристика: строение, классификация и номенклатура. Физические и химические свойства. Методы получения и идентификации. Биологически значимые аминокислоты.
- •27.Белки. Общая характеристика: строение и свойства белков. Классификация белков. Функции белков.
- •Классификация белков
- •28.Углеводы. Общая характеристика. Моносахариды. Строение, классификация, номенклатура. Оптическая изомерия. Физические и химические свойства.
- •29.Дисахариды. Строение, химические свойства отдельных представителей.
- •Мальтоза
- •30.Полисахариды. Строение, химические свойства отдельных представителей.
- •31.Карбоновые кислоты и их производные. Общая характеристика: номенклатура и изомерия. Физические и химические свойства. Методы получения и идентификации. Отдельные представители.
- •32.Липиды. Строение и свойства липидов. Классификация липидов. Физические и химические свойства жиров. Аналитическая характеристика жиров. Мыла и детергенты. Воски. Сложные липиды.
- •Жирные кислоты
20.Ароматические углеводороды (арены). Общая характеристика: строение, изомерия, номенклатура. Физические и химические свойства. Методы получения и идентификации. Отдельные представители.
Ароматическими называются соединения, в молекуле которых имеется циклическая группа атомов с особым характером связи - ядро бензола. Международное название ароматических углеводородов - арены.
Простейшим представителем аренов является бензол С6Н6. Формула, отражающая строение молекулы бензола, была впервые предложена немецким химиком Кекуле (1865):
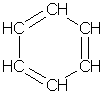
Атомы углерода в молекуле бензола образуют правильный плоский шестиугольник, хотя обычно его рисуют вытянутым.
Окончательно строение молекулы бензола подтверждено реакцией образования его из ацетилена. В структурной формуле изображается по три одинарных и три двойных чередующихся углерод-углеродных связей. Но такое изображение не передает истинного строения молекулы. В действительности углерод-углеродные связи в бензоле равноценны, и они обладают свойствами, не похожими на свойства ни одинарных, ни двойных связей. Эти особенности объясняются электронным строением молекулы бензола.
Гомологический ряд бензола имеет общую формулу СnН2n-6. Гомологи можно рассматривать как производные бензола, в котором один или несколько атомов водорода замещены различными углеводородными радикалами. Например, С6Н5-СН3 - метилбензол или толуол, С6Н4(СН3)2 - диметилбензол или ксилол, С6Н5—С2Н5 - этилбензол и т.д.
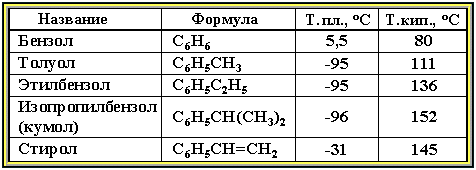
Физические свойства.
Бензол и его ближайшие гомологи – бесцветные жидкие вещества (см. табл.), нерастворимые в воде, но хорошо растворяющиеся во многих органических жидкостях. Легче воды. Огнеопасны. Бензол токсичен (поражает почки, печень, костный мозг, кровь).
Физические
свойства аренов
Химические свойства:
Присоединение В реакции присоединения, приводящие к разрушению ароматической структуры бензольного кольца, арены могут вступать с большим трудом.
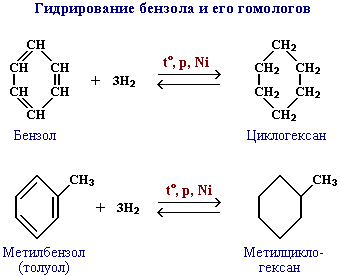
А)Гидрирование
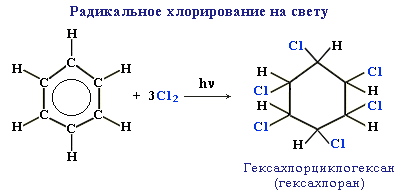
Б)Радикальное хлорирование
Получение
Каталитическая дегидроциклизация алканов, то есть отщепление водорода с одновременной циклизацией. Реакция осуществляется при повышенной температуре с использованием катализатора, например оксида хрома.
Каталитическое дегидрирование циклогексана и его производных. В качестве катализатора используется палладиевая чернь или платина при 300 °C.
Циклическая тримеризация ацетилена и его гомологов над активированным углем при 600 °C.
Алкилирование бензола галогенопроизводными или олефинами.
21.Спирты и фенолы. Общая характеристика: номенклатура и изомерия. Физические и химические свойства. Методы получения и идентификации. Отдельные представители
Спирты́ (от лат. spiritus — дух; устар. алкого́ли) — органические соединения, содержащие одну или более гидроксильных групп (гидроксил, −OH), непосредственно связанных с насыщенным (находящемся в состоянии sp³ гибридизации) атомом углерода[1]. Спирты можно рассматривать как производные воды (H−O−H), в которых один атом водорода замещен на органическую функциональную группу: R−O−H.
Спирты являются обширным и очень разнообразным классом органических соединений: они широко распространены в природе, имеют важнейшее промышленное значение и обладают исключительными химическими свойствами.
Классификация спиртов
Спирты классифицируются следующим образом (в скобках приведены примеры)[5]:
По числу гидроксильных групп:
— одноатомные спирты (метанол); — двухатомные спирты (этиленгликоль); — трехатомные спирты (глицерин); — четырёхатомные спирты (пентаэритрит); — многоатомные спирты (пятиатомный спирт: ксилит). |
|
|
|
|
В зависимости от насыщенности углеводородного заместителя:
— предельные или насыщенные спирты (бутанол); — непредельные или ненасыщенные спирты (аллиловый спирт, пропаргиловый спирт); — ароматические спирты (бензиловый спирт). |
|
В зависимости от наличия или отсутствия цикла в углеводородном заместителе:
— алициклические спирты (циклогексанол); — алифатические или ациклические спирты (этанол). |
|
В зависимости от того, при каком атоме углерода находится гидроксильная группа:
— первичные спирты (пропанол); — вторичные спирты (изопропиловый спирт); — третичные спирты (2-метилпропан-2-ол). |
Номенклатура спиртов
Правила построения названия спиртов (функциональная группа −OH):
1. Выбирается родительский углеводород по самой длинной непрерывной углеводородной цепи, содержащей функциональную группу. Он формирует базовое название (по числу атомов углерода).
2. Родительский углеводород нумеруется в направлении, которое дает суффиксу функциональной группы самое низкое число.
3. Если в соединении помимо функциональной группы имеется другой заместитель, суффикс функциональной группы получает самое низкое число.
4. Если для суффикса функциональной группы получено одно и то же число в обоих направлениях, цепь нумеруется в направлении, которое дает другому заместителю самое низкое число.
5. Если имеется несколько заместителей, они перечисляются в алфавитном порядке.
Для многоатомных спиртов перед суффиксом -ол по-гречески (-ди-, -три-, …) указывается количество гидроксильных групп (например: пропан-1,2,3-триол).
Физические свойства спиртов.
Между молекулами спиртов возникают водородные связи это приводит к тому, что спирты имеют аномально высокие для своей молекулярной массы температуры кипения. По этой же причине, первые представители спиртов являются жидкостями, а не газами. Высшие спирты(начиная с С12Н25ОН) при комнатной температуре- твердые вещества. Низшие спирты имеют характерный алкогольный запах и жгучий вкус, они хорошо растворимы в воде. По мере увеличения углеводородного радикала растворимость спиртов в воде понижается, и октанол уже не смешивается водой.
Химические свойства спиртов
Все химические реакции спиртов можно разделить на три условных группы, связанные с определёнными реакционными центрами и химическими связями:
Разрыв связи O−H (реакционный центр — водород)
Разрыв или присоединение по связи С−OH (реакционный центр — кислород)
Разрыв связи −СOH (реакционный центр — углерод)
Образование алкоголятов
2 R−OH + 2 Na → 2 R−O−Na+ + H2↑
R−OH + NaOH ⇌ R−O-Na+ + H2O (равновесие смещено влево)
Нуклеофильное замещение

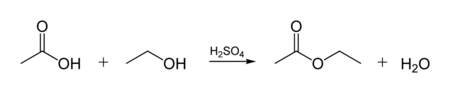
По тому же механизму происходит в условиях кислотного катализа реакция этерификации (взаимодействие спиртов с карбоновыми кислотами, приводящая к получению сложных эфиров):
Дегидратация
 4.
Окисление
4.
Окисление
Первичные спирты (R−CH2−OH) могут быть окислены до альдегидов (R−CHO), а дальнейшее окисление, которое часто бывает трудно приостановить, приводит к карбоновым кислотам(R−CO2H). Окисление вторичных спиртов (R1R2CH−OH) как правило заканчивается на стадии кетонов (R1R2C=O) без разрыва углеводородной цепи. Третичные спирты (R1R2R3C−OH) устойчивы к окислению, а при вступлении в реакцию образуют смесь карбоновых кислот.
Получение спиртов
1.реакции окисления — основаны на окислении углеводородов (реже — галогенпроизводных углеводородов), содержащих кратные или активированные C−H связи;
![]()
![]()
2.реакции восстановления — восстановление карбонильных соединений: альдегидов, кетонов, карбоновых кислот и сложных эфиров;
![]()
![]()
3.реакции гидратации — кислотно-катализируемое присоединение воды к алкенам (гидратация);
![]()
![]()
4.реакции присоединения:
![]()
Фено́лы — органические соединения ароматического ряда, в молекулах которых гидроксильные группы связаны с атомами углеродаароматического кольца. По числу ОН-групп различают:
одноатомные фенолы (аренолы): фенол (C6H5OH) и его гомологи;
двухатомные фенолы (арендиолы): гидрохинон, пирокатехин, резорцин;
трёхатомные фенолы (арентриолы): пирогаллол, флороглюцин, гидроксигидрохинон и т. д.
