
- •1.Предмет,задачи и методы физиологии растений.
- •6.Основные постулаты современной клеточной теории.
- •7.Структурные различия растительной и живой клеток.
- •11.Общая характеристика класса растительных белков. Белки растений, их состав, структура и функции.
- •12.Общая характеристика класса углеводов и их роль в жизнедеятельности растений.
- •14.Общая характеристика класса липидов и их химическая природа и функции в растении.
- •15.Общая характеристика класса нуклеиновых кислот. Их состав, структура и функции.
- •Каждый нуклеотид содержит три различных компонента: азотистое (пуриновое или пиримидиновое) основание, моносахарид пентозу (рибозу или дезоксирибозу) (Rb), остаток фосфорной кислоты (p).
- •Состав днк
- •16.Биосинтез белка и его регуляция.
- •22.Механизмы выделения и поглощения веществ растительной клеткой.
- •24.Движущая сила заряженных частиц и низкомолекулярных соединений(диффузия, облегченная диффузия, массовый поток, ионные насосы, переносчики, циклоз).
- •27.Общие представления о водном обмене растений.
- •34.Понятие о ближнем, среднем и дальнем транспорте воды в растении.
- •76. Общие представления о минеральном питании растений.
- •77. Роль минерального питания в обеспечении автотрофности растительного организма. Основные функции неорганических питательных элементов в растении.
- •78. Критерии необходимости элементов минерального питания для растений. Группы микро- и макроэлементов (принцип деления).
- •79. Корень как орган поглощения и усвоения питательных веществ.
- •80. Физиологическая роль и структурная организация ближнего, среднего и дальнего транспорта элементов минерального питания в растении.
- •81.Распределение по органам, накопление и реутилизация элементов минерального питания. Физиологические основы диагностики обеспеченности растений элементами минерального питания.
- •82. Биосинтетическая деятельность корня, ее взаимосвязь с органами надземных органов.
- •83. Физиологические основы выращивания растений без почвы, использование в практике защищенного грунта.
- •84. Физиологическая роль азота в обеспеченности питания растений аммонийными и нитратными формами.
- •85. Физиолого-биохимические особенности симбиотической азотфиксации.
- •86. Физиологическая роль фосфора и серы; их усвояемые формы, поглощение и распределение в растении. Внешние признаки недостатка этих элементов.
- •87. Физиологическая роль микроэлементов (Co, Zn, Mo и др). Их распределение в растении и внешние признаки недостатка.
- •88. Связь минерального питания с фотосинтезом и дыханием.
- •1.Особенности анатомо-морфологической структуры листа как органа фотосинтеза.
- •1. Эпидермис
- •2. Мезофилл, или хлоренхима
- •3. Проводящие ткани.
- •2)Химический состав, структура и функции хлоропластов.
- •I. Структура хлоропластов
- •II. Химический состав хлоропластов
- •4)Пигменты листа, их химическая природа и оптические свойства. Роль пигментов в процессе фотосинтеза. Пигменты листа, их химическая природа и оптические свойства
- •I. Зеленые пигменты – хлорофиллы
- •3. Оптические свойства хлорофиллов
- •II.Каротиноиды
- •5)Световая фаза фотосинтеза.
- •53.Общее представление о дыхание у растений и связанном с ним обмене веществ.
- •54.Общее и порциальное уравнения дыхания
- •55. Роль дыхания в жизни растения
- •56.Биологическое окисление. Основная дыхательная цепь( схема уравнения реакций )
- •57.Классификация ферментов дыхания
- •58.Дегидрогиназы растений, их химическая природа и функции
- •59.Оксидазы, их химическая природа и функции
- •59.Общая характеристика гликолиза
- •60.Окислительное фосфорилирование
- •62.Энергетика дыхания, вклад в нее анаэробной и аэробной фаз
- •63.Дополнительные дыхательные цепи .
- •64.Хемиосмотическая теория окислительного фосфорилирования
- •65.Использования энергии, высвобождающейся в процессе дыхания в растительном организме. Субстраты дыхания
- •66.Влияние внешних и внутренних факторов на интенсивность дыхания.
- •67.Дыхательные коэффициент, способ его определения и возможность использования для физиологической характеристики растительных объектов.
3. Оптические свойства хлорофиллов
Молекулы пигментов неспособны одинаково эффективно поглощать свет с разной длиной волны. Разные фотосинтетические пигменты лучше поглощают одни лучи и хуже – другие. Та длина волны, которая лучше всего поглощается данным пигментом, называется максимумом поглощения этого пигмента. Хлорофиллы а и b сильнее поглощают свет в красной и сине-фиолетовой области солнечного спектра, очень слабо поглощают оранжевые и желтые лучи и совсем не поглощают зеленые лучи, поэтому растения имеют зеленый цвет
II.Каротиноиды
Каротиноиды – это жирорастворимые пигменты желтого, оранжевого и красного цветов. Они, как и хлорофиллы, обязательно содержатся в растении, но их окраска обычно замаскирована хлорофиллом и проявляется только осенью, когда хлорофилл разрушается. Как и хлорофиллы, каротиноиды находятся в мембранах хлоропластов в растворенном состоянии.
Структура каротиноидов
Молекула каротиноидов в общем виде представляет собой линейную цепочку, построенную из 8 остатков углеводорода изопрена, которые образуют цепочку из чередующихся одинарных и двойных связей (как и у хлорофиллов). Если молекула каротиноида не содержит атомов кислорода, то он называется каротином, а если содержит – ксантофиллом. Из каротинов в растениях наиболее распространены α- и β-каротины, а из ксантофиллов – зеаксантин и лютеин.
Функции каротиноидов
Каротиноиды выполняют в растении следующие функции:
1.Каротиноиды – это обязательные компоненты светособирающих комплексов в хлоропластах. Молекулы каротиноидов поглощают свет в синей и фиолетовой части спектра, а затем передают поглощенную энергию на молекулы хлорофилла.
2.Каротиноиды защищают хлорофилл от окисления кислородом под действием света (фотоокисления), а также предохраняют от окисления мембраны тилакоидов в хлоропластах.
3.Каротиноиды часто в большом количестве присутствуют в цветках и плодах, что наряду с другими пигментами делает плоды более привлекательными для животных, распространяющих семена.
5)Световая фаза фотосинтеза.
Фотосинтез — синтез органических веществ из углекислого газа и воды с обязательным использованием энергии света:
6СО2 + 6Н2О + Qсвета → С6Н12О6 + 6О2.
У высших растений органом фотосинтеза является лист, органоидами фотосинтеза — хлоропласты (строение хлоропластов —лекция №7). В мембраны тилакоидов хлоропластов встроены фотосинтетические пигменты: хлорофиллы и каротиноиды. Существует несколько разных типов хлорофилла (a, b, c, d), главным является хлорофилл a. В молекуле хлорофилла можно выделить порфириновую «головку» с атомом магния в центре и фитольный «хвост». Порфириновая «головка» представляет собой плоскую структуру, является гидрофильной и поэтому лежит на той поверхности мембраны, которая обращена к водной среде стромы. Фитольный «хвост» — гидрофобный и за счет этого удерживает молекулу хлорофилла в мембране.
Хлорофиллы поглощают красный и сине-фиолетовый свет, отражают зеленый и поэтому придают растениям характерную зеленую окраску. Молекулы хлорофилла в мембранах тилакоидов организованы в фотосистемы. У растений и синезеленых водорослей имеются фотосистема-1 и фотосистема-2, у фотосинтезирующих бактерий — фотосистема-1. Только фотосистема-2 может разлагать воду с выделением кислорода и отбирать электроны у водорода воды.
Фотосинтез — сложный многоступенчатый процесс; реакции фотосинтеза подразделяют на две группы: реакции световой фазы и реакции темновой фазы.
Световая фаза
Эта фаза происходит только в присутствии света в мембранах тилакоидов при участии хлорофилла, белков-переносчиков электронов и фермента — АТФ-синтетазы. Под действием кванта света электроны хлорофилла возбуждаются, покидают молекулу и попадают на внешнюю сторону мембраны тилакоида, которая в итоге заряжается отрицательно. Окисленные молекулы хлорофилла восстанавливаются, отбирая электроны у воды, находящейся во внутритилакоидном пространстве. Это приводит к распаду или фотолизу воды:
Н2О + Qсвета → Н+ + ОН—.
Ионы гидроксила отдают свои электроны, превращаясь в реакционноспособные радикалы •ОН:
ОН— → •ОН + е—.
Радикалы •ОН объединяются, образуя воду и свободный кислород:
4НО• → 2Н2О + О2.
Кислород при этом удаляется во внешнюю среду, а протоны накапливаются внутри тилакоида в «протонном резервуаре». В результате мембрана тилакоида с одной стороны за счет Н+ заряжается положительно, с другой за счет электронов — отрицательно. Когда разность потенциалов между наружной и внутренней сторонами мембраны тилакоида достигает 200 мВ, протоны проталкиваются через каналы АТФ-синтетазы и происходит фосфорилирование АДФ до АТФ; атомарный водород идет на восстановление специфического переносчика НАДФ+ (никотинамидадениндинуклеотидфосфат) до НАДФ·Н2:
2Н+ + 2е— + НАДФ → НАДФ·Н2.
Таким образом, в световую фазу происходит фотолиз воды, который сопровождается тремя важнейшими процессами: 1) синтезом АТФ; 2) образованием НАДФ·Н2; 3) образованием кислорода. Кислород диффундирует в атмосферу, АТФ и НАДФ·Н2транспортируются в строму хлоропласта и участвуют в процессах темновой фазы.
фотофосфорилирование.
Нециклическое фосфорилирование. Возбужденные электроны от P680 (ФС1) и Р700 (ФСП) восстанавливают, соответственно, акцепторы электронов X и Y и, таким образом, Р680 и Р700становятся положительно заряженными (окисленными). Донором электронов, который обеспечивает восполнение электронов в Р680 является вода. Вода расщепляется, высвобождая электроны, которые и проникают в Р680. При этом высвобождаются также ионы кислорода и водорода. Кислород улетучивается в качестве побочного продукта.Электроны перемещаются от X вдоль цепи переноса электронов, каждый раз теряя некоторое количество энергии при переходе от одного переносчика к другому. В конечном счете они насыщают положительные дыры, оставленные в Р700 - Энергия потока используется для получения АТФ. Кроме того, электроны движугся вниз по градиенту энергии от Y к НАДФ вдоль цепи переноса электронов, взаимодействуют с ионами водорода (из воды), образуя восстановленный НАДФ-
Циклическое фотофосфорилированиеПри циклическом фотофосфорилировании электроны от Y возвращаются обратно к Р700 по другой цепи переноса электронов. Как и при нециклическом фосфорилировании энергия возбуждения электронов, перемещающихся вдоль этой цепи, направляется на получение АТФ.В таблице перечислены различия между циклическим и нециклическим фотофосфорилированием.Суммарное уравнение для нециклического фотофосфорилирования выглядит так:
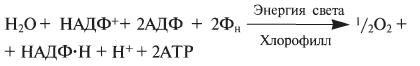
Дополнительное количество АТФ может образовываться при циклическом фотофосфорилировании. Эффективность превращения энергии в ходе световых реакций высока и составляет около 39%.
Сравнение циклического и нециклического фотофосфорилирования

С 3 -путь фотосинтеза Восстановительный пентозофосфатный цикл фиксации CO2 (С3-путь, или цикл Кальвина), открытый американскими учеными Э. Бенсоном и М. Калвином (см. КАЛВИН Мелвин)в 1950-е годы, универсален и обнаруживается практически у всех автотрофных организмов. В этом цикле (рис.5) фиксация СО2 осуществляется на пятиуглеродное соединение рибулезобисфосфат (РуБФ) при участии фермента рибулезобисфосфаткарбоксилазы (РуБФ-карбоксилазы). Первым стабильным продуктом являются две молекулы трехуглеродного соединения 3-фосфоглицериновой кислоты (3-ФГК), восстанавливаемая затем с использованием АТФ и НАДФН до трехуглеводных сахаров, из которых образуется конечный продукт фотосинтеза — шестиуглеродная глюкоза. Субстратом ключевого фермента фотосинтетической фиксации СО2 — РуБФ-карбоксилазы — наряду с СО2 может быть и О2. При взаимодействии РуБФ с кислородом реализуется гликолатный, или С2-путь, известный как фотодыхание. Большинство наземных растений осуществляют фотосинтез по С3-пути. Типичные представители этой группы — горох, фасоль, конские бобы, шпинат, салат, капуста, пшеница, овес, рожь, ячмень, свекла, подсолнечник, тыква, томаты и другие одно- и двудольные растения. С 4 -путь фотосинтеза У некоторых видов растений (в основном тропических и очень небольшого числа видов из умеренных широт) первыми стабильными соединениями при фиксации СО2 являются четырехуглеродные органические кислоты — яблочная и аспарагиновая. Такие растения отличаются видимым отсутствием фотодыхания (или очень низким уровнем), высокой скоростью фиксации СО2 в расчете на единицу поверхности листа, более высокой общей фотосинтетической продуктивностью, быстрой скоростью роста. Функционально и анатомически в ткани их листьев выделяют 2 типа фотосинтезирующих клеток — клетки паренхимной обкладки, окружающие проводящие пучки, и клетки мезофилла. Для всех растений этой группы характерна катализируемая ферментом фосфоенолпируваткарбоксилазой (ФЕП-карбоксилазой) фиксация СО2на трехуглеродное соединение фосфоенолпируват (ФЕП) с образованием щавелевоуксусной кислоты, которая далее превращается в яблочную (малат) или аспарагиновую кислоту. Эти реакции протекают в цитоплазме клеток мезофилла листа. С4-кислоты затем поступают в клетки обкладки проводящих пучков, где подвергаются декарбоксилированию, а высвободившаяся СО2 фиксируется через цикл Кальвина. Следовательно, у С4-растений фотосинтетический метаболизм углерода пространственно разделен и осуществляется в клетках различного типа, т. е. по «кооперативному механизму», подробно описанному австралийскими исследователями М. Хетчем и К Слэком и советским биохимиком Ю. С. Карпиловым в конце 1960—1970 годов. В соответствии с первичным механизмом декарбоксилирования С4-кислот все С4-растения подразделяются на три группы. НАДФ-малатдегидрогеназные растения осуществляют декарбоксилирование малата с помощью фермента НАДФ-малатдегидрогеназы в хлоропластах клеток обкладки проводящих пучков. Типичные представители этой группы — кукуруза, сахарный тростник, сорго, росичка кроваво-красная и другие злаки. НАД-малатдегидрогеназные растения осуществляют декарбоксилирование малата с помощью митохондриальной НАД-малатдегидрогеназы. Первичным продуктом фиксации углекислоты у них является аспартат. К типичным представителям этой группы принадлежат различные виды амаранта, портулак огородный, просо обыкновенное, бизонья трава, растущая в прериях Северной Америки и др. Фосфоенолпируват-карбоксикиназные растения осуществляют декарбоксилирование аспартата в цитоплазме клеток обкладки проводящих пучков с образованием ФЕП. Типичные представители — некоторые виды проса, хлориса, бутелуа. У суккулентных растений, произрастающих в условиях водного дефицита, фиксация СО2 осуществляется с помощью так называемого САМ-пути (метаболизм кислот по типу растений семейства толстянковых). Первичный продукт фиксации углекислоты (яблочная кислота) образуется у них в темновой период и накапливается в вакуолях клеток листа. В дневное время при закрытых устьицах (которые закрываются для сохранения воды в тканях листа) осуществляется декарбоксилирование этой кислоты, а освобождающаяся СО2 поступает в цикл Кальвина. Возникновение С4- и САМ-путей фотоассимиляции СО2 связано с давлением на высшие наземные растения засушливого климата. С4-растения хорошо адаптированы к высокой интенсивности света, повышенным температурам и засухе. Оптимальная температура для осуществления фотосинтеза у них выше, чем у С3-растений. С4-растения наиболее многочисленны в зонах с высокими температурами. Они более экономно используют воду по сравнению с С3-растениями. В настоящее время известно, что все растения с С4-фотосинтезом — цветковые (из 19 семейств:16 — двудольных и 3 —однодольных). Не обнаружено ни одного семейства, которое бы состояло только из С4-растений.
Влияние на фотосинтез внутренних и внешних условий
Внутренние – проводимость листа (для СО2) тесно коррелирующая с ИФ.Есть устьичная и остаточная проводимость. последняя- гл. образом проводимость мезофилла. Проводимость- величина обратная сопротивлению (измеряется см/с).
Фотохимическое лимитирование фотосинтеза. Скорость фотосинтетического метаболизма лимитируется поступлением энергии в в идее АТФ и НАНДФ*Н.
Биохимическое лимитирование Ф-за.. реакции, катализируемые РДФ-карбоксилазой/оксигеназой – лимитирующее звено в скорости ассимиляции СО2.
Гормональный эффект. Из донорного листа наряду с ассимилятами экспортируется синтезируемые в хлоропластах в-ва гормональной природы, в том числе абсцизовая кислота(АБК). При торможении экспорта ассимилянтов, например, путем удаления бобов у сои устьичная проводимость ИФ резко снижаются. АБК растет в 10 раз. Это приводило к закрыванию устьиц и торможению фото-за. Частичное удаление корней тоже тормозит ф-з.
Донорно-акцепторные отношения. ИФ листа(донор) сильно зависит от запроса на ассимилянты со стороны потребляющих органов (акцептор). Так, удаление клубней с растений картохи или плодэлементов у томата подовляло ф-з.
Накопление углеводов. Повышение концентрации сахарозы или крахмала в листе рассматривалась как один из важных факторов, обуславлищих снижение ИФ(интенсивность фотосинтеза). Это не особо верный фактор, т.к. должно быть не только влияние накопления, но и еще куча всего. Но,в от избыток крахмала, например (по Мокроносову(1982)) может вызвать серьезные нарушения фотосинтеза.
Возраст листа(растения). ИФ быстро растет в период роста листовой пластинки, мах. Значение лостигает у завершившего рост листа. Затем идет постепенное снижение ИФ , которое обусловлено параллельным уменьш.проводимости устьиц и мезофилла для молекул СО2. Уменьшение хлорофилла в результате старения листа
Внешние- интенсивность света, спектральный состав света (качество света)(мах. Поглощения хлорофиллом квантов света в синей и красной областях спектра), Концентрации СО2 (при увеличении растет чистая продуктивность ф-за)и О2(с ростом концентрации выше атмосферной Инт. Фот-за подавляется из-за активации фотодыхания), температура (влияние обратимое и нет)(зависимость определяется условиями выращивания:если растили цветок в холоде, тораст. Имеет более высокую скорость поглощения СО2 в холоде), водный режим (мало воды ->устьица закрыты->Ф. снижен), минеральное питание (N,P,K.Fe и др АЗОТ!.) эл-ты влияют прямо или косвенно. Болезни растений(например, ржавчина, мучнистая роса – нарушение структуры фотосинтетического аппарата)// Совместоне действие факторов внешней среды(стресс-жара холод жара;свет и СО2 и тд.)
Влияние усл-вий на проц. ф/с. 1.Интен-ть света: По мере увелич. интен-ти света нарастание ф/с стан.все менее выражен., при достиж.опред.ур-ня освещ. наступает насыще-ние ф/с-кой актив-ности листа. При низких интен-тях света активир. нециклич.поток ē.Увелич.интен-ти света стимулирует циклич.поток ē и повы-шает долю циклич.транс.ē. В усл-ях избыт освещ-ти цикл. транс.м.играть защит.роль в хл/пл , источ.д/ допол.синтеза АТФ=>активация проц. ассими-ляции С. 2.Спектр.сос-в света: на синем свету-увелич.акт-ть ассими-ляции СО2(акт-ция транс.ē и фер-в С цикла), преим.синтез.орг.к-ты и аминок-ты, позднее -Белки, на красном-рас-мые Уг=> крахмал. 3.Конц-ция СО2: у С3-раст. при повыш. СО2, повыш интен-ть ф/с (увел. площ.листьев, возр.чистая прод-ть биомассы), а у С4-раст.-близкое к естеств.сод. О2: с увелич. конц. О2-интен-ть уменьш, и наоборот. 4.Температура: оптим=5-35ºС (обратим.проц), при тем-ре выше 35=>необр.потеря ф/с актив-ти (синтез АТФ и НАДФ*Н снижается и стан.лимитир).5.Водный режим: дефицит воды-закрыв.устьиц, не поступает СО2, сниж. транспир. 6.Мин. пит: недост. или наруш.соот-ние влияет на сод-ние хл/ф, число,р-ры, ультра-стр-ру хл/пл. Fe-хлороз, N-р-ры и ультрастр-ра хл/пл,усилив.гранальность, повыш.сод.Б-переносчиков. Р-сопротивление мезофилла поглощ.СО2. К-замыкание устьичн.кл-к. 7.Болезни раст: приводят к снижению интен-ти ф/с (наруш.ф/с аппарата
Фотосинтез и урожай.
Проблема снижения фотодыхания. Проблема повышения ИФ селикционно-генетическим путем.Повышенной ИФ отличаются скороспелые сорта, но у них низкая продуктивность.
Установлена положительная зависимость между ИФ и массой единицы площади листа,называемой удельной поверхностной плотностью(УПП). Отмечено также + влияние эректоидности листьев в посеве на освещенность нижних листьев и продуктивность посевов риса, ячменя, кукурузы и др. особенно на низких широтах. При этом ИФ посевов возросла.
Нецелесообразно улучшать Ф-з, если активные потребители ассимилянтов (аттрагирующие центры) не соответствуют увеличенному потоку ассимилянтов. Как считает Быков (1982) наиболее перспективен раздельный подход в селекции, при котором от особенностей физиологии культуры и места её возделывания предлагается конкретная программа улучшения её фотосинтетических признаков. Например, для кормовых культур (у них полезная вегетативная масса) предпочтительно увеличение площади листьев, пусть даже сопряженное с некоторым снижением ИФ)
Пути повышения продуктивности фотосинтеза фитоценоза.
Продуктивность посевов опред на ряду с ИФ и ИЛП(индекс листовой пластинки) длительностью функционирования фотосинтетического аппарата, характеризуемого показателем фотосинтетический потенциал(ФП) посева. ФП-число «рабочих дней» листовой поверхности посева,рассчитываемое как произведение полусуммы площадей листьев за два последующих определения на длительность периода между этими определениями в днях. ФП посева в связи как с биологической и хозяйственной продуктивностью растений и в нечерноземной зоне сост. 2,5-3,5 для зерновых и 1,5-2,0 млн.м2*дней/га для картофеля.
Например,для культурных растений Нужно относить растения к опред. Группе (условно )(например, листовой тип-пшеница,стеблевой-рожь,листово-колосовый – овес,ячмень (классификация Нальборчика))=> разработка агротехники,обработка посевов регуляторами роста и гербицидами
Методы изучения фотосинтеза.
делали-определение химических св-в пигментов листа(разделение пегментов по Крауссу- метод основан на различной рас творимости пигментов в спирте и бензине. Они не смешиваются,образуют 2 фазы-верхнюю бензиновую и нижнюю спиртовую, благодаря чему разделяются компоненты смеси пигментов. Бензин от хлорофилла позеленеет, а спирт от ксантофилла будет желто-золотой)
-определение интенсивности фотосинтеза по поглощению СО2 в токе воздуха(сущность метода в учете кол-ва СО2 в потоке воздуха,прошедшего мимо листа растения)
Делали -количестввенное определение пигментов(получение ацетоновой вытяжки. Навеску листьев мелят в ступке до каши,с добавлением немного диоксида кальция и кварцевого пескаи + ацетон, Всю эту дрянь фильтруют, дважды полощут в ацетоне, сливая его в колбу; растворителем доливают в колбу до метки, закрывают каучуковой пробкой и определяют на свету концентрацию пигментов)
Физиологические основы выращивания растений при искусственном освещении.
Анатомия листьев и стеблей, накопление пигментов, усвоение лучистой энергии, Фот-з и фотогенез- лабильные физиологические процессы.Основным фактором, вызывающим их изменчивость при прочих равных условиях являются спектральный состав излучения ламп.
Анатомическое строение листьев и стеблей служит важным биологическим показателем условий облучения, выращивания и физиологического состояния растений. Так, палисадная и губчатая паренхима наиболее развита у листьев под люминесцентными и ксеноновыми лампами, в результате чего удельная поверхностная плотность оказывается больше, чем под др. типами ламп.
При длинноволновом излучении под лампами накаливания и ксеноновыми стебли обычно вытягиваются; при коротковолновом под люминисцентными лампами и лампами ДРЛ наблюдается наоборот сильное сокращение междоузлий.В последнем случае лучше дифференцируются проводящие пучки,хор. Развиваются механические ткани и образуется много камбиальных клеток.
При облучении неоновыми , ртутными и ртутно-вольфрамовыми лампами ИФ значительно ниже.а дыхание-выше, что снижает продуктивность растений в сравнении с другими лампами
