
- •Кристаллические вещества
- •Типы кристаллических решеток
- •Изоморфизм и полиморфизм
- •Газообразные диэлектрики
- •Жидкие диэлектрики
- •Пластмассы и пленочные материалы
- •Стекло и керамика
- •Слюда и слюдяные материалы
- •Лаки, эмали, компаунды
- •Активные диэлектрики
- •Полимеры. Общие свойства
- •Диэлектрическая проницаемость
- •Ионные соединения
- •Электронная поляризация
- •Ионная поляризация
- •Релаксационные (замедленные) виды поляризации
- •Дипольно-релаксационная поляризация
- •Основные понятия о электропроводности диэлектриков: Зависимость тока от времени приложения постоянного напряжения
- •Токи абсорбции
- •Механизмы возникновения и уменьшения тока абсорбции Iабс
- •Зависимость tg полярных диэлектриков от температуры
- •Зависимость tgб от частоты
- •Определение электрической прочности
1. Классификация материалов
Классификация материалов: металлические, неметаллические и композиционные материалы. Металлические материалы подразделяются на цветные металлы, порошковые материалы. Неметаллические материалы: резина, стекло, керамика, пластические массы, ситаллы. Композиционные материалы являются составными материалами, в состав которых входят два и более материалов (стеклопластики).
Существует классификация материалов в зависимости от вида полуфабрикатов: листы, порошки, гранулы, волокна, профили и т. д.
Техника создания материалов положена в основу классификации по структуре.
Металлические материалы подразделяются на группы в соответствии с тем компонентом, который лежит в их основе. Материалы черной металлургии: сталь, чугуны, ферросплавы, сплавы, в которых основной компонент – железо. Материалы цветной металлургии: алюминий, медь, цинк, свинец, никель, олово.
Основу современной техники составляют металлы и металлические сплавы. Сегодня металлы являются самым универсальным по применению классом материалов. Для того чтобы повысить качество и надежность изделий, требуются новые материалы. Для решения этих проблем применяются композиционные, полимерные, порошковые материалы.
Металлы – вещества, которые обладают ковкостью, блеском, электропроводностью и теплопроводностью. В технике все металлические материалы называют металлами и делят на две группы.
Простые металлы – металлы, которые имеют небольшое количество примесей других металлов.
Сложные металлы – металлы, которые представляют сочетания простого металла как основы с другими элементами.
Три четверти всех элементов в периодической системе являются металлами.
2. Механизм конденсации вещества. Образование химических связей
КОНДЕНСАЦИЯ (от позднелат. condensatio - уплотнение, сгущение), переход в-ва из газообразного состояния в жидкое или твердое при докритич. параметрах; фазовый переход первого рода. Конденсация- экзотермич. процесс, при к-ром выделяется теплота фазового перехода - теплота конденсации. Конденсир. фаза может образовываться в объеме пара или на пов-сти твердого тела и жидкости, имеющих более низкую т-ру, чем т-ра насыщения пара при данном давлении (см. Росы точка). Конденсация происходит при изотермич. сжатии, адиабатич. расширении и охлаждении пара или одноврем. понижении его давления и т-ры, к-рое приводит к тому, что конденсиров. фаза становится термодинамически более устойчивой, чем газообразная. Если при этом давление и т-ра выше, чем в тройной точке для данного в-ва, образуется жидкость (сжижение), если ниже - в-во переходит в твердое состояние, минуя жидкое (десублимация). Конденсация широко применяется в хим. технологии для разделения смесей посредством конденсации фракционной, при сушке и очистке в-в и др., в энергетике, напр. в конденсаторах паровых турбин, в холодильной технике для конденсации рабочего тела, в опреснит. установках и др. При конденсации паров в узких порах адсорбентов последние могут поглощать значит. кол-ва в-ва из газовой фазы (см. Капиллярная конденсация). Следствие конденсации водяного пара в атмосфере - дождь, снег, роса, иней. Конденсация в жидкое состояние. В случае конденсации в объеме пара или парогазовой смеси (гомогенная конденсация) конденсир. фаза образуется в виде мелких капель жидкости (тумана) или мелких кристаллов. Для этого необходимо наличие центров конденсации, к-рыми могут служить очень мелкие капельки жидкости (зародыши), образующиеся в результате флуктуации плотности газовой фазы, пылинки и частицы, несущие электрич. заряд (ионы). При отсутствии центров конденсации пар может в течение длит. времени находиться в т. наз. метастабильном (пересыщенном) состоянии. Устойчивая гомог. конденсация начинается при т. наз. критич. пересыщении Пкp=pк/pн где рк - равновесное давление, соответствующее критич. диаметру зародышей, рн - давление насыщ. пара над плоской пов-стью жидкости (напр., для водяного пара в воздухе, очищенном от твердых частиц или ионов, Пкр=5-8). Образование тумана наблюдается как в природе, так и в технол. аппаратах, напр. при охлаждении парогазовой смеси вследствие лучеиспускания, смешении влажных газов. Конденсация на пов-сти твердого тела насыщенного или перегретого пара происходит при т-ре пов-сти, к-рая меньше, чем т-ра насыщения пара при его равновесном давлении над ней. Наблюдается во многих пром. аппаратах, к-рые служат для конденсации целевых продуктов, подогрева разл. сред, разделения паровых и парогазовых смесей, охлаждения влажных газов и т.д. При сжижении пара на пов-сти твердого тела, хорошо смачивающейся конденсатом, образуется сплошная пленка жидкости (пленочная конденсация); на пов-сти, не смачивающейся конденсатом или смачивающейся частично, - отдельные капли (капельная конденсация); на пов-сти с неоднородными св-вами (напр., на полированной металлической с окисленными загрязненными участками) - зоны, покрытые пленкой конденсата и каплями (смешанная конденсация). При пленочной конденсации чистых паров неметаллов коэф. теплоотдачи определяется в осн. термич. сопротивлением пленки конденсата, к-рое зависит от режима ее течения. Последний в случае практически неподвижного пара определяется числом Рейнольдса пленки: Rепл=w/vк, где w, - соотв. средняя по сечению скорость и толщина пленки конденсата, vк - кинематич. вязкость конденсата. Для конденсации на вертикальной пластине или трубе при Rепл менее 5-8 течение пленки чисто ламинарное, при превышении этих значений Rепл - ламинарно-волновое, при Reпл>>350-400 - турбулентное. На вертикальных пoв-стях значит. высоты могут наблюдаться области с разл. режимами течения пленки конденсата. При ламинарном течении увеличение Reпл с возрастанием толщины пленки приводит к уменьшению коэф. теплоотдачи, при турбулентном течении - к его увеличению. Если пар перегрет, конденсация сопровождается конвективной теплоотдачей от пара к конденсату, т-ра поверхности к-рого практически равна т-ре насыщения при давлении пара. Для в-в с большой теплотой конденсации (напр., вода, спирты) теплота перегрева обычно незначительна по сравнению с теплотой конденсации, и ею можно пренебречь. В случае пленочной конденсации движущегося пара касательное напряжение на пов-сти раздела фаз, обусловленное межфазным трением и переносом импульса частицами сконденсировавшегося пара, к-рые присоединяются к пленке конденсата, вызывает при нисходящем потоке пара увеличение скорости и уменьшение толщины пленки, в результате чего коэф. теплоотдачи увеличивается. При более высоких скоростях парового потока воздействие его на пленку конденсата может приводить не только к изменению ее скорости и толщины, но и к возмущению течения (образование волн, турбулизация), интенсифицирующему теплоперенос в пленке. Если поток пара направлен вверх, движение ламинарной пленки конденсата тормозится, толщина ее увеличивается и коэф. теплоотдачи уменьшается по мере возрастания скорости пара до тех пор, пока действие межфазного трения не вызовет т. наз. обращенное (направленное вверх) течение пленки конденсата. При конденсации движущегося пара внутри трубы (канала) режимы течения и характер взаимод. паровой и жидкой фаз могут значительно изменяться в результате изменения по мере образования конденсата скорости пара, касательного напряжения трения на межфазной пов-сти и Reпл. При больших скоростях пара (когда действие силы тяжести на пленку конденсата пренебрежимо мало и течение ее определяется в осн. силой трения) местные и средние по длине трубы коэф. теплоотдачи не зависят от пространств. ориентации трубы. Если силы тяжести и трения соизмеримы, условия конденсации определяются углом наклона трубы и взаимным направлением движения фаз. В случае конденсации внутри горизонтальной трубы и малой скорости пара кольцевая пленка конденсата образуется только на верх, части внутренней пов-сти трубы. На ниж. части возникает "ручей", в зоне к-рого в результате относительно большой толщины слоя жидкости теплоотдача значительно менее интенсивна, чем на остальном участке пов-сти. В случае конденсации на пучке горизонтальных труб расход стекающего конденсата увеличивается сверху вниз вследствие натекания конденсата с вышележащих труб на нижележащие, а расход пара по пути его движения снижается. В пучке с постоянным или относительно немного уменьшающимся по высоте живым сечением между трубами скорость нисходящего потока пара постепенно снижается, а конденсат натекает с верх, труб на нижние. Вначале это приводит к уменьшению местных коэф. теплоотдачи (осредненных по периметру труб) при увеличении отсчитываемого сверху номера горизонтального ряда труб. Однако, начиная с нек-рого ряда, в результате натекания конденсата течение пленки возмущается и ее термич. сопротивление снижается. Благодаря этому коэф. теплоотдачи могут стабилизироваться, а при возрастающем воздействии возмущения течения пленки на ниж. трубках - увеличиваться с возрастанием номера ряда. Интенсификация теплоотдачи при пленочной конденсации может достигаться профилированием ее пов-сти (напр., применением т, наз. мелковолнистой пов-сти), к-рое способствует уменьшению средней толщины пленки конденсата, созданием на пов-сти искусств, шероховатости, приводящей к тур-булизации пленки, воздействием на нее при диэлектрич. жидкой фазе (напр., при конденсации хладонов) электростатич. полем, отсосом конденсата через пористую пов-сть и др. При конденсации паров жидких металлов теплопроводность жидкой фазы весьма высока. Поэтому доля термич. сопротивления пленки конденсата в суммарном сопротивлении передаче тепла незначительна, и определяющим оказывается межфазное термич. сопротивление, обусловленное молекулярно-кинетич. эффектами на границе раздела фаз. Иногда пленочная конденсация на пов-сти сопровождается гомог. конденсацией в прилегающем к пов-сти раздела фаз слое пара. Если образование тумана при этом нежелательно (напр., в произ-ве H2SO4 нитрозным способом или при улавливании летучих р-рителей), процесс проводят при макс. пересыщении пара ниже Пкр. При капельной конденсации первичные мелкие капли, образовавшиеся на сухой вертикальной или наклонной пов-сти, растут в результате продолжения процесса, слияния близко расположенных и касающихся друг друга капель и подтягивания к ним возникающей между каплями и быстро разрывающейся тонкой пленки конденсата. Капли, достигшие "отрывного" диаметра, стекают вниз, объединяясь (коалес-цируя) с нижележащими мелкими каплями, после чего на освободившейся пов-сти опять образуются мелкие капли, и цикл повторяется. Условия, определяющие самопроизвольное возникновение капельной конденсации, наблюдаются редко. Обычно же для осуществления капельной конденсации на твердую пов-сть наносят тонкий слой лиофобизатора - в-ва, обладающего низким поверхностным натяжением и несмачиваемого конденсатом (напр., жиры, воски). В случае капельной конденсации коэф. теплоотдачи намного выше (в 5-10 раз и более), чем при пленочной. Однако поддержание в условиях эксплуатации пром. аппаратов устойчивой капельной конденсации затруднительно. Поэтому конденсац. устройства хим. пром-сти, как правило, работают в режиме пленочной конденсации. Конденсация пара на пов-сти жидкости того же в-ва происходит в технол. аппаратах на пов-сти подаваемых в объем пара диспергированных (напр., с помощью распылит, форсунок) струй или стекающих по насадке тонких пленок жидкости. Диспергирование или распределение жидкости на тонкие пленки позволяет сильно развить пов-сть контакта фаз. В ряде случаев конденсация наблюдается при поступлении пара в объем жидкости в виде струй или пузырьков (барботаж), а также при образовании паровых пузырьков в объеме жидкости, напр. при кавитации. Конденсация пара из смеси его с неконденсирующимися газами (или неконденсирующимися при данной т-ре парами) на пов-сти твердого тела или жидкости менее интенсивна по сравнению с конденсацией чистого пара. Поскольку при конденсации из парогазовой смеси т-ра и парциальное давление (концентрация) пара в ее осн. массе выше, чем на твердой пов-сти, в прилегающем к последней слое смеси (при движении смеси - в пограничном слое) происходит совместный тепло- и массообмен. Если пар неподвижен, даже незначит. содержание в нем газа приводит к резкому снижению интенсивности конденсации. По мере увеличения скорости (числа Рейнольдса Reсм) парогазовой смеси влияние газа на интенсивность процесса постепенно ослабляется. При конденсации паров из многокомпонентных смесей (паровых или парогазовых) в газовой фазе также происходят взаимосвязанные тепло- и массоперенос. При этом эффективный коэф. теплопроводности смеси и эффективные коэф. диффузии ее отдельных компонентов определяются природой и концентрациями др. компонентов. В случае гомог. смеси конденсатов на пов-сти твердого тела происходит только пленочная конденсация, в случае гетерогенной - смешанная. Напр., при конденсациибинарной смеси водяного пара и орг. в-ва на твердой пов-сти образуется жидкая пленка этого в-ва, покрывающаяся каплями влаги.
При образовании химической связи происходит перераспределение в пространстве электронных плотностей, первоначально принадлежавших разным атомам. Поскольку наименее прочно связаны с ядром электроны внешнего уровня, то этим электронам принадлежит главная роль в образовании химической связи. Количество химических связей, образованных данным атомом в соединении, называют валентностью. Электроны, принимающие участие в образовании химической связи, называются валентными: у s- и р элементов — это внешние электроны, у d- элементов — внешние (последние) s-электроны и предпоследние d-электроны. С энергетической точки зрения наиболее устойчивым является атом, на внешнем уровне которого содержится максимальное число электронов (2 и 8 электронов). Такой уровень называют завершенным. Завершенные уровни отличаются большой прочностью и характерны для атомов благородных газов, поэтому при обычных условиях они находятся в состоянии химически инертного одноатомного газа. У атомов других элементов внешние энергетические уровни незавершенные. В процессе хим реакции осуществляется завершение внешних уровней, что достигается либо присоединением, либо отдачей электронов, а также образованием общих электронных пар. Эти способы приводят к образованию двух основных типов связи: ковалентной и ионной. Таким образом, при образовании молекулы каждый атом стремится приобрести устойчивую внешнюю электронную оболочку: либо двухэлектронную (дублет), либо восьми-злектромную (октет). Эта закономерность положена в основу теории образования химической связи. Образование химической связи за счет завершения внешних уровней в образующих связь атомах сопровождается выделением большого количества энергии, то есть возникновение химической связи всегда протекает экзотермически, поскольку оно приводит к появлению новых частиц (молекул), обладающих при обычных условиях большей устойчивостью, а следовательно, они меньшей энергией, чем у исходных. Одним из существенных показателей, определяющих какая связь образуется между атомами, является электроотрицательность, то есть способность атомом притягивать к себе электроны от других атомов. Электроотрицательность атомов элементов изменяется постепенно: в периодах периодической системы слева направо ее значение возрастает а в группах сверху вниз — уменьшается.
3. Типы химических связей
Химическая связь, осуществляемая за счет образования общих (связывающих) электронных пар, называется ковалентной.1) Разберем пример образования химической связи между атомами с одинаковой электроотрицательностью, например, молекулы водорода Н2 Образование химической связи в молекуле водорода можно представить в виде двух точек: Н- + -Н -> Н : Н или черточкой, которая символизирует пару электронов: H-H Ковалентная связь, образованная атомами с одинаковой электроотрицательностью называется неполярной. Такую связь образуют двухатомные молекулы, состоящие из атомов одного химического элемента: H 2 , Cl 2 и др.2) Образование ковалентной связи между атомами, электроотрицательность которых различается незначительно. Ковалентная связь, образованная атомами с различной электроотрицательностью, называется полярной. При ковалентной полярной связи электронная плотность от общей пары электронов смещена к атому с большей электроотрицательностью. Примерами могут служить молекулы Н2О, NH3, H2S, CH3Cl. Ковалентная (полярная и неполярная) связь в наших примерах образовалась за счет неспаренных электронов связывающихся атомов. Такой механизм образования ковалентной связи называется обменным. Другой механизм образования ковалентной связи — донорно-акцепторный. В этом случае связь возникает за счет двух спаренных электронов одного атома (донора) и свободной орбитали другого атома (акцептор). Хорошо известный пример — образование иона аммония: Н++:NH 3 -> [ Н : NH3 | + <=====> NH4+ акцептор донор ион аммония электронов. При образовании иона аммония электронная пара азота становится общей для атомов N и Н, то есть возникает четвертая связь, которая не отличается от остальных трех. Их изображают одинаково:
Н+
H-N-H
Н
Ионная связь возникает между атомами, электроотрицательность которых резко различается Рассмотрим способ образования на примере хлорида натрия NaCl. Электронную конфигурацию атомов натрия и хлора можно представить: 11 Na ls2 2s2 2p 6 3s1; 17 Cl ls2 2p 6 Зs2 3р5 Как это атомы с незавершенными энергетическими уровнями. Очевидно, для их завершения атому натрия легче отдать один электрон, чем присоединить семь, а атому хлора легче присоединить один электрон, чем отдать семь. При химическом взаимодействии атом натрия полностью отдает один электрон, а атом хлора принимает его. Схематично это можно записать так: Na. — l е —> Na+ ион натрия, устойчивая восьмиэлектронная 1s2 2s2 2p6 оболочка за счет второго энергетического уровня. :Cl + 1е --> .Cl - ион хлора, устойчивая восьмиэлектронная оболочка. Между ионами Na+ и Cl- возникают силы электростатического притяжения, в результате чего образуется соединение. Химическая связь, осуществляемая за счет электростатического притяжения между ионами, называется ионной связью. Соединения, образованные путем притяжения ионов называются ионными. Ионные соединения состоят из отдельных молекул только в парообразном состоянии. В твердом (кристаллическом) состоянии ионные соединения состоят из закономерно расположенных положительных и отрицательных ионов. Молекулы в этом случае отсутствуют. Ионные соединения образуют резко различные по величине электроотрицательности элементы главных подгрупп I и II групп и главных подгрупп VI и VII групп. Ионных соединений сравнительно немного. Например неорганические соли: NH4Cl (ион аммония NH4 + и ион хлора Cl-), а также солеобразные органические соединения: алкоголяты соли карбоновых кислот, соли аминов Неполярная ковалентная связь и ионная связь — два предельных случая распределения электронной плотности. Неполярной связи отвечает равномерное распределение связующего двух электронного облака между одинаковыми атомами. Наоборот, при ионной связи связующие электронное облако практически полностью принадлежит одному из атомов. В большинстве же соединений химические связи оказывают промежуточными между этими видами связи, то есть в них осуществляется полярная ковалентная связь. Металлическая связь существует в металлах в твердом в жидком состоянии. В соответствии с положением в периодической системе атомы металлов имеют небольшое число валентных электронов (1-3 электрона) и низкую энергию ионизации (отрыва электрона). Поэтому валентные электроны слабо удерживаются в атоме, легко отрываются и имеют возможность перемещаться по всему кристаллу. В узлах кристаллической решетки металлов находятся свободные атомы, положительно заряженные коны, а часть валентных электронов, свободно перемещаясь в объеме кристаллической решетки, образует «электронный газ», обеспечивающий связь между атомами металла. Связь, которую осуществляют относительно свободные электроны между ионами металлов в кристаллической решетке, называется металлической связью. Металлическая связь возникает за счет обобществления атомами валентных электронов. Однако между этими видами связи есть существенное различие. Электроны, осуществляющие ковалентную связь, в основном пребывают в непосредственной близости от двух соединенных атомов. В случае металлической связи электроны, осуществляющие связь, перемещаются по всему куску металла. Этим определяются общие признаки металлов: металлический блеск, хорошая проводимость теплоты и электричества, ковкость, пластичность и т. д. Общим химическим свойством металлов является их относительно высокая восстановительная способность. Водородные связи могут образовываться между атомом водорода, связанным с атомом электроотрицательного элемента, и электроотрицательным элементом, имеющим свободную пару электронов(О,F,N). Водородная связь обусловлена электростатическим притяжением, которому способствуют малые размеры атома водорода, и отчасти, донорно-акцепторным взаимодействием. Водородная связь может быть межмолекулярной и внутримолекулярной. Связи 0-Н имеют выраженный полярный характер: Водородная связь гораздо более слабая, чем ионная или ковалентная, но более сильная, чем межмолекулярное взаимодействие. Водородные связи обуславливают некоторые физические свойства веществ (например, высокие температуры кипения). Особенно распространены водородные связи в молекулах белков, нуклеиновых кислот и других биологически важных соединений, обеспечивая им определенную пространственную структуру (организацию).
4. Кристаллическое строение вещества. Типы кристаллических решёток.
Кристаллические вещества
Твердые кристаллы - трехмерные образования, характеризующиеся строгой повторяемостью одного и того же элемента структуры (элементарной ячейки) во всех направлениях. Элементарная ячейка представляет собой наименьший объем кристалла в виде параллелепипеда, повторяющегося в кристалле бесконечное число раз.
Геометрически правильная форма кристаллов обусловлена, прежде всего, их строго закономерным внутренним строением. Если вместо атомов, ионов или молекул в кристалле изобразить точки как центры тяжести этих частиц, то получится трехмерное регулярное распределение таких точек, называемое кристаллической решеткой. Сами точки называют узлами кристаллической решетки.
Типы кристаллических решеток
В зависимости от того, из каких частицы построена кристаллическая решетка и каков характер химической связи между ними, выделяют различные типы кристаллов.
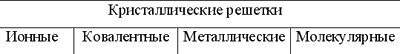
Ионные кристаллы образованы катионами и анионами (например, соли и гидроксиды большинства металлов). В них между частицами имеется ионная связь.
И онные
кристаллы могут состоять из одноатомных
ионов. Так построены кристаллы хлорида
натрия,
иодида калия, фторида кальция.
В
образовании ионных кристаллов многих
солей участвуют одноатомные катионы
металлов и многоатомные анионы, например,
нитрат-ион NO3−,
сульфат-ион SO42−,
карбонат-ион CO32−.
онные
кристаллы могут состоять из одноатомных
ионов. Так построены кристаллы хлорида
натрия,
иодида калия, фторида кальция.
В
образовании ионных кристаллов многих
солей участвуют одноатомные катионы
металлов и многоатомные анионы, например,
нитрат-ион NO3−,
сульфат-ион SO42−,
карбонат-ион CO32−.
В ионном кристалле невозможно выделить одиночные молекулы. Каждый катион притягивается к каждому аниону и отталкивается от других катионов. Весь кристалл можно считать огромной молекулой. Размеры такой молекулы не ограничены, поскольку она может расти, присоединяя новые катионы и анионы.
Большинство ионных соединений кристаллизуется по одному из структурных типов, которые отличаются друг от друга значением координационного числа, то есть числом соседей вокруг данного иона (4, 6 или 8). Для ионных соединений с равным числом катионов и анионов известно четыре основных типа кристаллических решеток: хлорида натрия (координационное число обоих ионов равно 6), хлорида цезия (координационное число обоих ионов равно 8), сфалерита и вюрцита (оба структурных типа характеризуются координационном числом катиона и аниона, равным 4). Если число катионов вдвое меньше числа анионов, то координационное число катионов должно быть вдвое больше координационного числа анионов. В этом случае реализуются структурные типы флюорита (координационные числа 8 и 4), рутила (координационные числа 6 и 3), кристобалита (координационные числа 4 и 2).
Обычно ионные кристаллы твердые, но хрупкие. Их хрупкость обусловлена тем, что даже при небольшой деформации кристалла катионы и анионы смещаются таким образом, что силы отталкивания между одноименными ионами начинают преобладать над силами притяжения между катионами и анионами, и кристалл разрушается.
Ионные кристаллы отличаются высокими температурами плавления. В расплавленном состоянии вещества, образующие ионные кристаллы, электропроводны. При растворении в воде эти вещества диссоциируют на катионы и анионы, и образующиеся растворы проводят электрический ток.
Высокая растворимость в полярных растворителях, сопровождающаяся электролитической диссоциацией обусловлена тем, что в среде растворителя с высокой диэлектрической проницаемостью ε уменьшается энергия притяжения между ионами. Диэлектрическая проницаемость воды в 82 раза выше, чем вакуума (условно существующего в ионном кристалле), во столько же раз уменьшается притяжение между ионами в водном растворе. Эффект усиливается за счет сольватации ионов.
Атомные кристаллы состоят из отдельных атомов, объединенных ковалентными связями. Из простых веществ только бор и элементы IVA-группы имеют такие кристаллические решетки. Нередко соединения неметаллов друг с другом (например, диоксид кремния) также образуют атомные кристаллы.
Так же как и ионные, атомные кристаллы можно считать гигантскими молекулами. Они очень прочные и твердые, плохо проводят теплоту и электричество. Вещества, имеющие атомные кристаллические решетки, плавятся при высоких температурах. Они практически нерастворимы в каких-либо растворителях. Для них характерна низкая реакционная способность.
Молекулярные кристаллы построены из отдельных молекул, внутри которых атомы соединены ковалентными связями. Между молекулами действуют более слабые межмолекулярные силы. Они легко разрушаются, поэтому молекулярные кристаллы имеют низкие температуры плавления, малую твердость, высокую летучесть. Вещества, образующие молекулярные кристаллические решетки, не обладают электрической проводимостью, их растворы и расплавы также не проводят электрический ток.
Межмолекулярные силы возникают за счет электростатического взаимодействия отрицательно заряженных электронов одной молекулы с положительно заряженными ядрами соседних молекул. На силу межмолекулярного взаимодействия влияет много факторов. Важнейшими среди них является наличие полярных связей, то есть смещения электронной плотности от одних атомов к другим. Кроме того, межмолекулярное взаимодействие проявляется сильнее между молекулами с большим числом электронов.
Б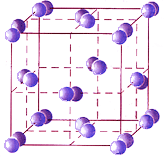 ольшинство
неметаллов в виде простых веществ
(например, иод
I2,
аргон Ar, сера S8)
и соединений друг с другом (например,
вода, диоксид углерода, хлороводород),
а также практически все твердые
органические вещества образуют
молекулярные кристаллы.
ольшинство
неметаллов в виде простых веществ
(например, иод
I2,
аргон Ar, сера S8)
и соединений друг с другом (например,
вода, диоксид углерода, хлороводород),
а также практически все твердые
органические вещества образуют
молекулярные кристаллы.
Для металлов характерна металлическая кристаллическая решетка. В ней имеется металлическая связь между атомами. В металлических кристаллах ядра атомов расположены таким образом, чтобы их упаковка была как можно более плотной. Связь в таких кристаллах является делокализованной и распространяется на весь кристалл. Металлические кристаллы обладают высокой электрической проводимостью и теплопроводностью, металлическим блеском и непрозрачностью, легкой деформируемостью.
К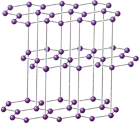 лассификация
кристаллических решеток отвечает
предельным случаям. Большинство
кристаллов неорганических веществ
принадлежит к промежуточным типам -
ковалентно-ионным, молекулярно-ковалентным
и т.д. Например, в кристалле графита
внутри каждого слоя связи
ковалентно-металлические, а между слоями
- межмолекулярные.
лассификация
кристаллических решеток отвечает
предельным случаям. Большинство
кристаллов неорганических веществ
принадлежит к промежуточным типам -
ковалентно-ионным, молекулярно-ковалентным
и т.д. Например, в кристалле графита
внутри каждого слоя связи
ковалентно-металлические, а между слоями
- межмолекулярные.
