
36.Теплоемкость вещества (удельная, молярная). Связь между теплоемкостями. Уравнение Майера.
Теплоёмкость
тела С
назыв. Отношение
теплоты
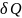 ,
сообщ.телу изменению температуры dT
при этом в данном термодинамич.процессе:
,
сообщ.телу изменению температуры dT
при этом в данном термодинамич.процессе:
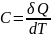
Удельная
теплоём.
Теплоёмкость
единицы массы вещества: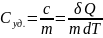
Молярная
теплоём.
Теплоёмкость одного моля вещества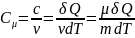
Уравнение
Майера :
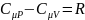
Для удел.теплоём.:
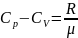
Для теплоём.тела.:
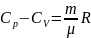
Урв.Майера говорит о том, что для изобарного нагревания газа к нему должна подводиться большая теплота, чем для такого же изохорного нагревания, на величину работы, соверш.газом при изобарном расширении:
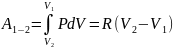
 I
начало термодинамики. Изопроцессы.
I
начало термодинамики. Изопроцессы.
I
начало термодинамики теплота
сообщаемая системе, расходуется на
изменение внутр.энергии dU
системы и на совершение системой работы
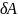 против внеш.сил:
против внеш.сил:
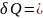 dU+
dU+
Для изохорного
процесса:
V=const,
m=const
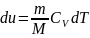
Для изотермич.
Процесса:
T=const,
m=const
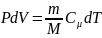
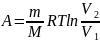
Для изобарного
процесса: P=const,
m=const,
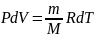 ,
Q=
dU+A=dU+pdU
,
Q=
dU+A=dU+pdU
Для адиабатного процесса:
38.Адиабатный процесс. Уравнение адиабаты.
Адиабатный
процесс термодинамич.процесс,
происходящий без теплообмена с окр.средой
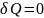
Уравнение
адиабаты
Продифференц. Уравнение Менделеева-Кларейрона
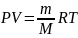 :
:
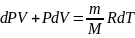
Запишем I начало термодинамики для адиабат.процесса
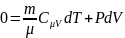
Выразим dT и подставим
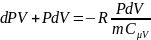
Разделим на PV

Cледовательно

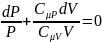
Отношение
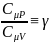 назыв. Показателем адиабаты или
коэффиц.Пуассона.
назыв. Показателем адиабаты или
коэффиц.Пуассона.
Таким образом
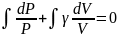
Следовательно
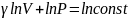
Отсюда
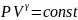 – урав.адиабаты
– урав.адиабаты
39.Работа, совершаемая газом в адиабатном процессе и в изопроцессах.
Работа, совершаемая
газом в адиабатном:
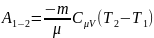 (1)
(1)
Найдём связь
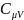 и
и
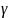 .
Из урав. Майера
.
Из урав. Майера
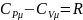 и определения
и определения
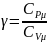 следует что
следует что
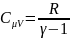 (2)
(2)
Подставим выражение
(2) в (1) получим:

Т.к.
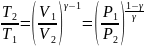 то можно найти ещё 2 выражения для
работы:
то можно найти ещё 2 выражения для
работы: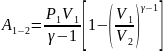 ,
,
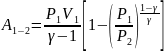
Работа, совершаемая газом в изотермическом:
Работа, совершаемая газом в изобарном: A = p (V2 – V1) = pΔV
Работа, совершаемая газом в изохорном: A = 0
40.Политропный процесс. Работа в политропном процессе.
Политропный процесс
обобщает 4 процесса одной формулой:
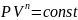
В др.термодинамич.переменных
урав.политропы имеет вид: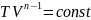 ,
,
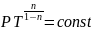
Если n=0
– изобара, n=1-изотерма,
n=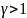 -адиабата,
n
-адиабата,
n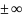 -изохора
-изохора
Работа в политропном процессе равна:
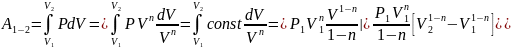
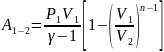
41.Теплоемкость вещества для различных процессов.
Теплоемкость газа
в изотермич.процессе: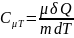
Теплоемкость
моляр.при адиабат.процессе:
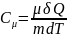
Теплоемкость для
политропного.процесса:
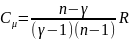
Теплоемкость газа
в изохорном.процессе: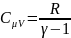
Теплоемкость газа
в изобарном.процессе: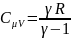
42.Обратимые и необратимые процессы. Энтропия.
Процесс назыв.обратимым, если после него можно возвратить систему в исходное состояние так,что в окр.среде не останется никаких изменений. В противном случае процесс необратим.все реальные процессы необратимы, они сопровождаются трением, теплообменом при конеч. Разности температур тел,наход.в тепловом контакте.
Энтропией
назыв.функ. S
состояния системы,дифференциал в
обратимом процессе равен отношению
малого количества теплоты
сообщ.системе к абсолютной тмпературе
системы: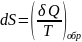
43.Термодинамика диаграммы Т – S для различных процессов.
При изучении термодинамических процессов удобно пользоваться T-S диаграммами, в кот.по осям абсцисс и ординат отложены соответственно энтропия S и термодинамич.температура T системы.
Рис.43 стр.76
Изотермич.процесс:
изотермич.расшир., dS>0-теплота подводиться
изотермич.сжатие, dS<0-теплота сводиться
Адиабатный процесс:
температура увелич., dT>0-V уменьш.,адиабат.сжатие
dT<0-температура уменьш.V увелич., адиабат.расшир.
рис.44 стр.77
Изохорный процесс:
изохор.нагревание., dS>0, dT>0
изохор.охлаждение, dS<0, dT<0
S=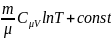
Рис.45 стр.77
Изобарный процесс
изобарное расшир.., dS>0, dT>0
изобарное сжатие., dS<0, dT<0
рис.46,47 стр.78
S=
44.Энергия Гельмгольца
Для обратимых процессов выполняется термодинамич.тождество:
TdS=dU+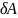 или
или
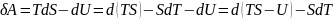
Величина F=U-TS явл. Функ. Состояния тела и назыв.энергией Гельмгольца или свободной энергией.
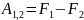
Работа соверш.телом в обратимом изотермич.процессе равна убыли в этом процесее энергии Гельмгольца рассматриваемого тела. т.к. TS>0 то F составляет лишь часть внутренней энергии тела. Величина TS назыв. связанной энергией эту часть внутр.энергии нельзя передать в форме работы в обратимом изотермич.процессе.
45.II и III начало термодинамики
