
- •Основные стехиометрические законы.
- •Закон химических эквивалентов. Молярные массы эквивалентов сложных веществ.
- •Волновые свойства электрона. Квантовые числа состояния электрона. Электронные орбитали.
- •Принцип Паули. Емкость энергетических уровней и подуровней атомов элементов.
- •Связь периодического закона со строением электронных оболочек атомов. Правило Клечковского Энергетические ячейки. Правило Хунда.
- •Периодический закон д.И.Менделеева и периодическая система элементов: ряды, периоды, группы, подгруппы, порядковый номер элемента.
- •Периодическое изменение свойств химических элементов. Радиус атомов, сродство к электрону, энергия ионизации, электроотрицательность.
- •Образование химической связи. Энергия и длина связи.
- •Ковалентная (атомная) связь. Метод валентных связей. Возбужденные состояния атомов. Валентность.
- •Направленность ковалентной связи. Π – связи. Гибридизация атомных орбиталей.
- •Ионная (электронная) связь.
- •Представление о методе электронных орбиталей.
- •Полярность связи. Полярность молекул и дипольный момент.
- •Донорно-акцепторный механизм ковалентной связи. Комплексные соединения.
- •Межмолекулярное взаимодействие. Водородная связь.
- •Система. Фаза. Компонент. Параметры. Функция состояния: внутренняя энергия и энтальпия. Стандартные условия.
- •Первое начало термодинамики. Закон Гесса как следствие первого начала термодинамики. Термохимические расчеты.
- •Стандартная энтальпия образования. Следствие из закона Гесса.
- •Зависимость теплового эффекта химической реакции от температуры (закон Кирхгоффа).
- •Второе начало термодинамики. Понятие об энтропии. Расчет энтропии.
- •Постулат Планка. Стандартная энтропия веществ.
- •Объединенная формула первого и второго начал термодинамики. Свободная энергия Гиббса и Гельмгольца.
- •Зависимость f и g от температуры (уравнения Гиббса-Гельмгольца).
- •Условия самопроизвольного протекания химических реакций.
- •Изотерма химической реакции. Стандартное изменение свободной энергии.
- •Константа химического равновесия. Различные способы выражения констант равновесия . Соотношения между константами.
- •Зависимость константы химического равновесия от температуры (изобара и изохора химической реакции).
- •Принцип Ле-Шателье.
- •Скорость химической реакции. Закон действующих масс. Константа скорости.
- •Молекулярность и порядок реакции.
- •Кинетическая классификация по степени сложности. Обратимые и необратимые реакции.
- •Зависимость скорости химической реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса.
- •Энергия активации химической реакции. Аналитический и графический метод расчета.
- •Скорость гетерогенной химической реакции. Особенности ее протекания.
- •Инициирование химических реакций. Катализ. Сущность гомогенного и гетерогенного катализа.
- •Дисперсные системы. Коллоидные растворы.
- •Растворы (разбавленные, концентрированные, насыщенные, пересыщенные). Растворимость. Способы выражения концентраций растворов.
- •Физические и химические процессы при растворении. Растворимость твердых тел и жидкостей в жидкостях.
- •Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
- •Закон Рауля. Криоскопия и эбуллиоскопия.
- •Электролитическая диссоциация. Закон разведения Оствальда.
- •Сильные электролиты. Понятие активности и коэффициента активности.
- •Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель. Понятие об индикаторах.
- •Гидролиз солей. Константа и степень гидролиза.
- •Произведение растворимости. Условие выпадения осадка.
- •Овр. Ионно-электронный метод подбора коэффициентов в овр.
- •Возникновение скачка потенциала на границе раздела «металл-раствор». Равновесный электродный потенциал.
- •Медно-цинковый гальванический элемент Якоби-Даниэля. Процессы на электродах. Понятие эдс.
- •Зависимость эдс гальванического элемента от природы реагирующих веществ, температуры и концентрации. Стандартная эдс.
- •Стандартный водородный электрод. Формула Нернста. Стандартный потенциал. Ряд напряжений. Расчет эдс гальванического элемента.
- •Типы электродов и цепей. Окислительно-восстановительные электроды и цепи.
- •Электролиз. Последовательность разряда ионов на катоде и аноде.
- •Законы Фарадея. Выход по току. Понятие химической и концентрационной поляризации при электролизе. Перенапряжение.
- •Классификация химических источников тока.
- •Коррозия металлов. Химическая и электрохимическая коррозия.
- •Основные методы борьбы с коррозией.
- •Кристаллическое состояние вещества. Химическая связь в кристаллах.
- •Составные части системы и компоненты. Правило фаз. Диаграмма состояния однокомпонентной системы (на примере воды). ???? диаграмма
- •Сущность термографического анализа. Кривые нагревания и охлаждения. Принцип построения диаграммы плавкости бинарной системы.
- •Эвтектическая диаграмма плавкости (без образования твердых растворов).
- •Поверхностные явления. Понятие поверхностного натяжения.
- •Адсорбция и абсорбция. Изотермы адсорбции.
Поверхностные явления. Понятие поверхностного натяжения.
Поверхностное натяжение – избыток
свободной энергии в поверхностном слое,
отнесенный к
![]() поверхности поглощающего тела.
поверхности поглощающего тела.
![]() Поверхностное
растяжение растворов зависит от природы
растворителя и растворенного вещества,
от концентрации последнего и от
температуры. Поверхностное натяжение
как функция концентрации растворенного
вещества при Т-const -
изотерма поверхностного
Поверхностное
растяжение растворов зависит от природы
растворителя и растворенного вещества,
от концентрации последнего и от
температуры. Поверхностное натяжение
как функция концентрации растворенного
вещества при Т-const -
изотерма поверхностного
 натяжения.
натяжения.
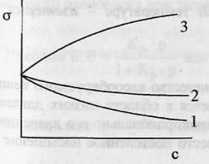
![]() 1
и 2 – поверхностно-активные вещества
(ПАВ).3 – поверхностно-инактивные вещества
(ПИАВ). Разность с в поверхностном
слое – поверхностный избыток вещества
Г (гамма).Для ПАВ Г>0, для ПИАВ
Г<0.Поверхность твердых тел, как и
жидкостей, обладает избыточной свободной
энергией Гиббса. Твердые тела не могут
(в отличие от жидкостей) самопроизвольно
изменять площадь поверхности.
1
и 2 – поверхностно-активные вещества
(ПАВ).3 – поверхностно-инактивные вещества
(ПИАВ). Разность с в поверхностном
слое – поверхностный избыток вещества
Г (гамма).Для ПАВ Г>0, для ПИАВ
Г<0.Поверхность твердых тел, как и
жидкостей, обладает избыточной свободной
энергией Гиббса. Твердые тела не могут
(в отличие от жидкостей) самопроизвольно
изменять площадь поверхности.
Адсорбция и абсорбция. Изотермы адсорбции.
Адсорбция-процесс изменения концентрации у поверхности раздела двух фаз, а в более узком и употребительном- это повышение концентрации одного вещества у поверхности раздела двух фаз, из которых одна обычно является твердым телом.
Поглощаемое вещество, ещё находящееся в объёме фазы, называют адсорбтив, поглощённое — адсорбат. В более узком смысле под адсорбцией часто понимают поглощение примеси из газа или жидкости твёрдым веществом — адсорбентом. При этом, как и в общем случае адсорбции, происходит концентрирование примеси на границе раздела адсорбент-жидкость либо адсорбент-газ. Процесс, обратный адсорбции, то есть перенос вещества с поверхности раздела фаз в объём фазы, называется десорбция.
Абсорбция- поглощения сорбата всем объёмом сорбента. Абсорбция — частный случай сорбции.
Абсорбция, как правило, означает поглощение газов в объёме жидкости или реже твёрдого тела. Поглощение твёрдым абсорбентом, например, водорода палладием, называют окклюзией. Для процесса поглощения молекул газа или жидкости поверхностью твёрдого тела в русском языке используется термин адсорбция.
На практике абсорбции подвергают не отдельные газы, а газовые смеси, составные части которых поглощаются жидкостью. Эти составные части смеси называют абсорбируемыми компонентами (абсорбат), а непоглощаемые части — инертным газом.
Поверхностное натяжение – избыток
свободной энергии в поверхностном слое,
отнесенный к
![]() поверхности поглощающего тела.
поверхности поглощающего тела.
![]() Поверхностное
растяжение растворов зависит от природы
растворителя и растворенного вещества,
от концентрации последнего и от
температуры. Поверхностное натяжение
как функция концентрации растворенного
вещества при Т-const -
изотерма поверхностного натяжения.
Поверхностное
растяжение растворов зависит от природы
растворителя и растворенного вещества,
от концентрации последнего и от
температуры. Поверхностное натяжение
как функция концентрации растворенного
вещества при Т-const -
изотерма поверхностного натяжения.
![]()
1 и 2 – поверхностно-активные вещества
(ПАВ).3 – поверхностно-инактивные вещества
(ПИАВ).Разность с в поверхностном
слое– поверхностный избыток вещества
Г (гамма).Для ПАВ Г>0, для ПИАВ
Г<0.Поверхность твердых тел, как и
жидкостей, обладает избыточной свободной
энергией Гиббса. Твердые тела не могут
(в отличие от жидкостей) самопроизвольно
изменять площадь поверхности.Величина
адсорбции зависит от природы адсорбента
и адсорбата, от давления газа,
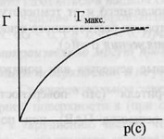
температуры.Зависимость адсорбируемого
количества газа от давления адсорбата
при постоянной температуре – изотерма
адсорбции. С ростом давления увеличивается
количество адсорбируемого вещества.Лэнгмюр
при выводе уравнения изотермы сделал
следующие допущения: 1. все
 места
адсорбента одинаковы. 2. взаимодействие
между частицами пренебрежимо мало. 3.
адсорбционный слой состоит из одного
слоя молекул, адсорбция локализованная
– нет перемещения адсорбционного
комплекса вдоль поверхности
адсорбента.Степень заполнения адсорбента
адсорбатом:
места
адсорбента одинаковы. 2. взаимодействие
между частицами пренебрежимо мало. 3.
адсорбционный слой состоит из одного
слоя молекул, адсорбция локализованная
– нет перемещения адсорбционного
комплекса вдоль поверхности
адсорбента.Степень заполнения адсорбента
адсорбатом:
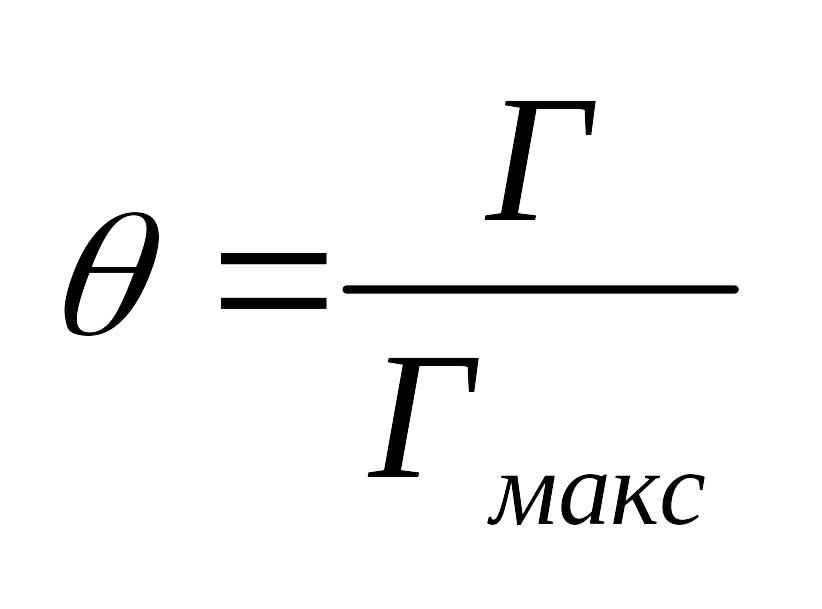 Скорость
адсорбции:
Скорость
адсорбции:
![]()
![]() константа скорости адсорбции.Скорость
десорбции:
константа скорости адсорбции.Скорость
десорбции:
![]()
![]() константа скорости десорбции.Адсорбционное
равновесие наступает при
константа скорости десорбции.Адсорбционное
равновесие наступает при
![]() Уравнение
изотермы хорошо передает зависимости
в области низких и области высоких
давлений, но не всегда оправдывается в
промежуточной области.Процесс адсорбции
экзотермичен: поглощение вещества
протекает с выделением теплоты, десорбция
– с поглощением теплоты.Если адсорбируются
несколько газов:
Уравнение
изотермы хорошо передает зависимости
в области низких и области высоких
давлений, но не всегда оправдывается в
промежуточной области.Процесс адсорбции
экзотермичен: поглощение вещества
протекает с выделением теплоты, десорбция
– с поглощением теплоты.Если адсорбируются
несколько газов:
![]() Для
адсорбции на неоднородной поверхностибыло
предложено эмпирическое уравнение
Фрейндлиха.
Для
адсорбции на неоднородной поверхностибыло
предложено эмпирическое уравнение
Фрейндлиха.![]()
![]() к
и n – коэффициенты,
постоянные для данного адсорбента и
газа при данной температуре. Уравнение
Фрейндлиха, наоборот, не отражает
особенностей изотермы в области высоких
и низких давлений, но для области
промежуточных давлений согласуются с
опытными данными.
к
и n – коэффициенты,
постоянные для данного адсорбента и
газа при данной температуре. Уравнение
Фрейндлиха, наоборот, не отражает
особенностей изотермы в области высоких
и низких давлений, но для области
промежуточных давлений согласуются с
опытными данными.
