
- •Основные стехиометрические законы.
- •Закон химических эквивалентов. Молярные массы эквивалентов сложных веществ.
- •Волновые свойства электрона. Квантовые числа состояния электрона. Электронные орбитали.
- •Принцип Паули. Емкость энергетических уровней и подуровней атомов элементов.
- •Связь периодического закона со строением электронных оболочек атомов. Правило Клечковского Энергетические ячейки. Правило Хунда.
- •Периодический закон д.И.Менделеева и периодическая система элементов: ряды, периоды, группы, подгруппы, порядковый номер элемента.
- •Периодическое изменение свойств химических элементов. Радиус атомов, сродство к электрону, энергия ионизации, электроотрицательность.
- •Образование химической связи. Энергия и длина связи.
- •Ковалентная (атомная) связь. Метод валентных связей. Возбужденные состояния атомов. Валентность.
- •Направленность ковалентной связи. Π – связи. Гибридизация атомных орбиталей.
- •Ионная (электронная) связь.
- •Представление о методе электронных орбиталей.
- •Полярность связи. Полярность молекул и дипольный момент.
- •Донорно-акцепторный механизм ковалентной связи. Комплексные соединения.
- •Межмолекулярное взаимодействие. Водородная связь.
- •Система. Фаза. Компонент. Параметры. Функция состояния: внутренняя энергия и энтальпия. Стандартные условия.
- •Первое начало термодинамики. Закон Гесса как следствие первого начала термодинамики. Термохимические расчеты.
- •Стандартная энтальпия образования. Следствие из закона Гесса.
- •Зависимость теплового эффекта химической реакции от температуры (закон Кирхгоффа).
- •Второе начало термодинамики. Понятие об энтропии. Расчет энтропии.
- •Постулат Планка. Стандартная энтропия веществ.
- •Объединенная формула первого и второго начал термодинамики. Свободная энергия Гиббса и Гельмгольца.
- •Зависимость f и g от температуры (уравнения Гиббса-Гельмгольца).
- •Условия самопроизвольного протекания химических реакций.
- •Изотерма химической реакции. Стандартное изменение свободной энергии.
- •Константа химического равновесия. Различные способы выражения констант равновесия . Соотношения между константами.
- •Зависимость константы химического равновесия от температуры (изобара и изохора химической реакции).
- •Принцип Ле-Шателье.
- •Скорость химической реакции. Закон действующих масс. Константа скорости.
- •Молекулярность и порядок реакции.
- •Кинетическая классификация по степени сложности. Обратимые и необратимые реакции.
- •Зависимость скорости химической реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса.
- •Энергия активации химической реакции. Аналитический и графический метод расчета.
- •Скорость гетерогенной химической реакции. Особенности ее протекания.
- •Инициирование химических реакций. Катализ. Сущность гомогенного и гетерогенного катализа.
- •Дисперсные системы. Коллоидные растворы.
- •Растворы (разбавленные, концентрированные, насыщенные, пересыщенные). Растворимость. Способы выражения концентраций растворов.
- •Физические и химические процессы при растворении. Растворимость твердых тел и жидкостей в жидкостях.
- •Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
- •Закон Рауля. Криоскопия и эбуллиоскопия.
- •Электролитическая диссоциация. Закон разведения Оствальда.
- •Сильные электролиты. Понятие активности и коэффициента активности.
- •Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель. Понятие об индикаторах.
- •Гидролиз солей. Константа и степень гидролиза.
- •Произведение растворимости. Условие выпадения осадка.
- •Овр. Ионно-электронный метод подбора коэффициентов в овр.
- •Возникновение скачка потенциала на границе раздела «металл-раствор». Равновесный электродный потенциал.
- •Медно-цинковый гальванический элемент Якоби-Даниэля. Процессы на электродах. Понятие эдс.
- •Зависимость эдс гальванического элемента от природы реагирующих веществ, температуры и концентрации. Стандартная эдс.
- •Стандартный водородный электрод. Формула Нернста. Стандартный потенциал. Ряд напряжений. Расчет эдс гальванического элемента.
- •Типы электродов и цепей. Окислительно-восстановительные электроды и цепи.
- •Электролиз. Последовательность разряда ионов на катоде и аноде.
- •Законы Фарадея. Выход по току. Понятие химической и концентрационной поляризации при электролизе. Перенапряжение.
- •Классификация химических источников тока.
- •Коррозия металлов. Химическая и электрохимическая коррозия.
- •Основные методы борьбы с коррозией.
- •Кристаллическое состояние вещества. Химическая связь в кристаллах.
- •Составные части системы и компоненты. Правило фаз. Диаграмма состояния однокомпонентной системы (на примере воды). ???? диаграмма
- •Сущность термографического анализа. Кривые нагревания и охлаждения. Принцип построения диаграммы плавкости бинарной системы.
- •Эвтектическая диаграмма плавкости (без образования твердых растворов).
- •Поверхностные явления. Понятие поверхностного натяжения.
- •Адсорбция и абсорбция. Изотермы адсорбции.
Сущность термографического анализа. Кривые нагревания и охлаждения. Принцип построения диаграммы плавкости бинарной системы.
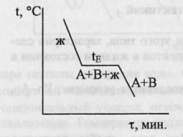
Термографический анализ – кривые нагревания или кривые охлаждения системы. Диаграммы плавкости (частный вид диагарамм состояния) строят исходя из кривых охлаждения, которые изображаются в координатах: температура(Оу), время(Ох). Рассмотрим кривые охлаждения двух систем. Система I в интервале t1-t2 не испытывает никаких фазовых превращений, температура меняется монотонно. Кривая II отвечают охлаждению воды от 150 o C (пар при атмосферном давлении) до 0 o C и ниже. При 100 o C наблюдается горизонтальный участок, отвечающий фазовому переходу – процессу конденсации пара, температура поддерживается низменной, пока не исчезнет весь пар. Постоянство температуры обеспечивается за счёт выделения в процессе конденсации пара теплоты испарения воды. От 100 o C до 0 o C наблюдается монотонный ход кривой охлаждения – остывает жидкая вода. При 0 o C наблюдается второй горизонтальный участок, отвечающий фазовому переходу – процессу кристаллизации. Температура поддерживается постоянной за счет выделения теплоты плавления.Рассмотрим кривые охлаждения чистого металла (I) и сплава с так называемой эвтектикой (II). На кривой охлаждения (I) чистого металла А наблюдается одна площадка bc, отвечающая процессу кристаллизации металла. При tпл в равновесии находятся жидкая и твердая фазы одинакового состава. Образование твердой фазы сопровождается выделением теплоты плавления.Кривая II отвечает охлаждению сплава А-В. От “а” до “a’ “ температура меняется монотонно, остывает жидкая фаза. При достижении точки a’ из жидкой фазы начинают выпадать кристаллы А – одного из компонентов сплава, при этом жидкая фаза за счет этого начнет обогащаться компонентом В. Таким образом, в интервале a’-b в равновесии находятся жидкая и твердая фазы различного состава, площадки на кривой охлаждения не наблюдается. За счет выделения при кристаллизации А теплоты плавления этого компонента темп охлаждения сплава замедляется, и на кривой наблюдается перелом. Выпадение кристаллов А продолжается до тех пор, пока жидкая фаза не достигнет так называемого “эвтектического состава”. Основной особенностью эвтектического сплава является то, что он кристаллизуется подобно чистому компоненту – на кривой охлаждения наблюдается площадка. Из жидкой фазы одновременно выпадают кристаллы А и В и, таким образом при tЕ (отрезок bc) в равновесии находятся жидкая и твердая фазы одинакового состава. Отрезок cd отвечают охлаждению твердого сплава.Остановки в падении температуры могут наблюдаться и на кривой охлаждения уже твердого металла, указываю на переходы металла из одной аллотропной формы в другую.
Эвтектическая диаграмма плавкости (без образования твердых растворов).
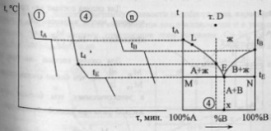
 Диаграмма
состояния системы - диаграмма,
указывающая, в каких фазовых состояниях
находится система в зависимости от
условий: температура, давление и состав.
Диаграммы плавкости – частный вид
диаграмм состояния. Для систем, дающих
диаграмму плавкости такого типа,
характерна полная взаимная
растворимость компонентов в жидком
состоянии и нерастворимость – в твердом.
Пример. Системы Pb-Ag,
Cd-Bi, Tl-Au,
KCl-LiCl и
т.д.Чтобы построить диаграмму плавкости
системы А-В, необходимо приготовить
несколько сплавов – от 100% А, через каждые
Диаграмма
состояния системы - диаграмма,
указывающая, в каких фазовых состояниях
находится система в зависимости от
условий: температура, давление и состав.
Диаграммы плавкости – частный вид
диаграмм состояния. Для систем, дающих
диаграмму плавкости такого типа,
характерна полная взаимная
растворимость компонентов в жидком
состоянии и нерастворимость – в твердом.
Пример. Системы Pb-Ag,
Cd-Bi, Tl-Au,
KCl-LiCl и
т.д.Чтобы построить диаграмму плавкости
системы А-В, необходимо приготовить
несколько сплавов – от 100% А, через каждые
![]() - до 100%В.Далее снимаются кривые охлаждения
и характерные точки переносятся на
диаграмму плавкости бинарной системы
А-В. Температуры плавления чистых
компонентов -tА и
tВ. Температура
начала первичной кристаллизации сплава
4 – t4, окончание –
tE.
Подобным же образом переносят характерные
точки для всех сплавов и соединяют их
на диаграмме плавными линиями, получая
в итоге диаграмму плавкости системы
A-B.Ломанная
линия tАЕtВ
- “линия ликвидуса”, выше нее
возможно существование лишь жидкой
фазы. Линия MEN – “линия
солидуса”, ниже нее – лишь твердая
фаза.Между солидусом и ликвидусом
область сосуществования двух фаз –
твердой и жидкой.Точка Е – точка
эвтектики, сплав эвтектического
состава кристаллизуется подобно чистому
компоненту, давая кривую охлаждения с
площадкой: для сплавов, имеющих состав
100%А до т. х (состава эвтектики) – так
называемых доэвтектических – под
микроскопом после затвердевания
наблюдаются сравнительно крупные
кристаллы компонента А, выпадающие
первоначально, и смесь мелких кристалликов
А и В, выпадающая при достижении жидкой
фазы эвтектического состава – в конце
кристаллизации.В сплавах после точки
х - заэвтектического состава –
наблюдаются крупные кристаллы В и
эвтектическая смесь кристалликов А и
В. Правило фаз в данном случае
записывается как С=К-Ф+1, посколько при
снятии диаграмм плавкости P=const.
Число степеней свободы: в точке D
– C=2-1+1=2, в точке L
– C=2-2+1=1, в точке Е –
С=2-3+1=0.
- до 100%В.Далее снимаются кривые охлаждения
и характерные точки переносятся на
диаграмму плавкости бинарной системы
А-В. Температуры плавления чистых
компонентов -tА и
tВ. Температура
начала первичной кристаллизации сплава
4 – t4, окончание –
tE.
Подобным же образом переносят характерные
точки для всех сплавов и соединяют их
на диаграмме плавными линиями, получая
в итоге диаграмму плавкости системы
A-B.Ломанная
линия tАЕtВ
- “линия ликвидуса”, выше нее
возможно существование лишь жидкой
фазы. Линия MEN – “линия
солидуса”, ниже нее – лишь твердая
фаза.Между солидусом и ликвидусом
область сосуществования двух фаз –
твердой и жидкой.Точка Е – точка
эвтектики, сплав эвтектического
состава кристаллизуется подобно чистому
компоненту, давая кривую охлаждения с
площадкой: для сплавов, имеющих состав
100%А до т. х (состава эвтектики) – так
называемых доэвтектических – под
микроскопом после затвердевания
наблюдаются сравнительно крупные
кристаллы компонента А, выпадающие
первоначально, и смесь мелких кристалликов
А и В, выпадающая при достижении жидкой
фазы эвтектического состава – в конце
кристаллизации.В сплавах после точки
х - заэвтектического состава –
наблюдаются крупные кристаллы В и
эвтектическая смесь кристалликов А и
В. Правило фаз в данном случае
записывается как С=К-Ф+1, посколько при
снятии диаграмм плавкости P=const.
Число степеней свободы: в точке D
– C=2-1+1=2, в точке L
– C=2-2+1=1, в точке Е –
С=2-3+1=0.
