
- •Основные стехиометрические законы.
- •Закон химических эквивалентов. Молярные массы эквивалентов сложных веществ.
- •Волновые свойства электрона. Квантовые числа состояния электрона. Электронные орбитали.
- •Принцип Паули. Емкость энергетических уровней и подуровней атомов элементов.
- •Связь периодического закона со строением электронных оболочек атомов. Правило Клечковского Энергетические ячейки. Правило Хунда.
- •Периодический закон д.И.Менделеева и периодическая система элементов: ряды, периоды, группы, подгруппы, порядковый номер элемента.
- •Периодическое изменение свойств химических элементов. Радиус атомов, сродство к электрону, энергия ионизации, электроотрицательность.
- •Образование химической связи. Энергия и длина связи.
- •Ковалентная (атомная) связь. Метод валентных связей. Возбужденные состояния атомов. Валентность.
- •Направленность ковалентной связи. Π – связи. Гибридизация атомных орбиталей.
- •Ионная (электронная) связь.
- •Представление о методе электронных орбиталей.
- •Полярность связи. Полярность молекул и дипольный момент.
- •Донорно-акцепторный механизм ковалентной связи. Комплексные соединения.
- •Межмолекулярное взаимодействие. Водородная связь.
- •Система. Фаза. Компонент. Параметры. Функция состояния: внутренняя энергия и энтальпия. Стандартные условия.
- •Первое начало термодинамики. Закон Гесса как следствие первого начала термодинамики. Термохимические расчеты.
- •Стандартная энтальпия образования. Следствие из закона Гесса.
- •Зависимость теплового эффекта химической реакции от температуры (закон Кирхгоффа).
- •Второе начало термодинамики. Понятие об энтропии. Расчет энтропии.
- •Постулат Планка. Стандартная энтропия веществ.
- •Объединенная формула первого и второго начал термодинамики. Свободная энергия Гиббса и Гельмгольца.
- •Зависимость f и g от температуры (уравнения Гиббса-Гельмгольца).
- •Условия самопроизвольного протекания химических реакций.
- •Изотерма химической реакции. Стандартное изменение свободной энергии.
- •Константа химического равновесия. Различные способы выражения констант равновесия . Соотношения между константами.
- •Зависимость константы химического равновесия от температуры (изобара и изохора химической реакции).
- •Принцип Ле-Шателье.
- •Скорость химической реакции. Закон действующих масс. Константа скорости.
- •Молекулярность и порядок реакции.
- •Кинетическая классификация по степени сложности. Обратимые и необратимые реакции.
- •Зависимость скорости химической реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса.
- •Энергия активации химической реакции. Аналитический и графический метод расчета.
- •Скорость гетерогенной химической реакции. Особенности ее протекания.
- •Инициирование химических реакций. Катализ. Сущность гомогенного и гетерогенного катализа.
- •Дисперсные системы. Коллоидные растворы.
- •Растворы (разбавленные, концентрированные, насыщенные, пересыщенные). Растворимость. Способы выражения концентраций растворов.
- •Физические и химические процессы при растворении. Растворимость твердых тел и жидкостей в жидкостях.
- •Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
- •Закон Рауля. Криоскопия и эбуллиоскопия.
- •Электролитическая диссоциация. Закон разведения Оствальда.
- •Сильные электролиты. Понятие активности и коэффициента активности.
- •Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель. Понятие об индикаторах.
- •Гидролиз солей. Константа и степень гидролиза.
- •Произведение растворимости. Условие выпадения осадка.
- •Овр. Ионно-электронный метод подбора коэффициентов в овр.
- •Возникновение скачка потенциала на границе раздела «металл-раствор». Равновесный электродный потенциал.
- •Медно-цинковый гальванический элемент Якоби-Даниэля. Процессы на электродах. Понятие эдс.
- •Зависимость эдс гальванического элемента от природы реагирующих веществ, температуры и концентрации. Стандартная эдс.
- •Стандартный водородный электрод. Формула Нернста. Стандартный потенциал. Ряд напряжений. Расчет эдс гальванического элемента.
- •Типы электродов и цепей. Окислительно-восстановительные электроды и цепи.
- •Электролиз. Последовательность разряда ионов на катоде и аноде.
- •Законы Фарадея. Выход по току. Понятие химической и концентрационной поляризации при электролизе. Перенапряжение.
- •Классификация химических источников тока.
- •Коррозия металлов. Химическая и электрохимическая коррозия.
- •Основные методы борьбы с коррозией.
- •Кристаллическое состояние вещества. Химическая связь в кристаллах.
- •Составные части системы и компоненты. Правило фаз. Диаграмма состояния однокомпонентной системы (на примере воды). ???? диаграмма
- •Сущность термографического анализа. Кривые нагревания и охлаждения. Принцип построения диаграммы плавкости бинарной системы.
- •Эвтектическая диаграмма плавкости (без образования твердых растворов).
- •Поверхностные явления. Понятие поверхностного натяжения.
- •Адсорбция и абсорбция. Изотермы адсорбции.
Растворы (разбавленные, концентрированные, насыщенные, пересыщенные). Растворимость. Способы выражения концентраций растворов.
Раствор - гомогенная система, в
которой одно вещество равномерно
распределено в среде другого. Р-р -
гомогенная система. В р-ре различают
растворитель и растворяемое
вещество.Р-ры газа в газе или жидкости
в жидкости называют смесями.
Разб.р-р–р-р, в котором содержание
одного из компонентов меньше содержания
другого компонента.Конц. р-р – р-р,
в котором отн-е кол-ва растворенного
вещ-ва и растворителя одного порядка.
Насыщ.р-р-растворенное вещ-во при
данных условиях более не растворяется,
даже при продолжительном перемешивании.
Концентрация насыщ-го раст-ра - мера
растворимости вещ-ва при данных условиях.
Раствор пересыщенный, если содержание
растворенного вещ-ва превышает предел
насыщения данного раствора.Пример.
При
![]() можно приготовить 20%-ный раствор
можно приготовить 20%-ный раствор
![]() .
Концентрация раст-ра – кол-ное
выражение его состава.Молярные доли
(дроби) показывают какую долю составляет
число молей данного компонента от общего
числа молей всех компонентов.Пример.
Компоненты А и В. Массы компонентов
.
Концентрация раст-ра – кол-ное
выражение его состава.Молярные доли
(дроби) показывают какую долю составляет
число молей данного компонента от общего
числа молей всех компонентов.Пример.
Компоненты А и В. Массы компонентов
![]() Число молей компонентов -
Число молей компонентов -
![]() Молярная
доля компонента А
Молярная
доля компонента А
![]()
![]() 2.
Процентное выражение концентрации
2.
Процентное выражение концентрации
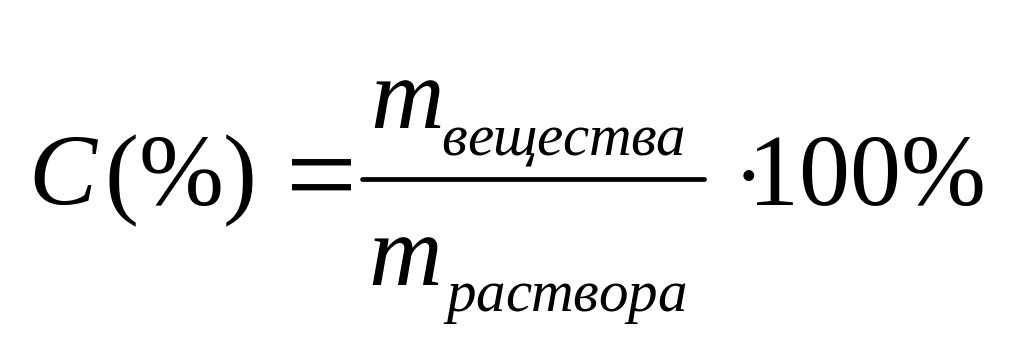 Концентрация,
выражаемая через плотность
раствора.Вычисляется с помощью
приборов и специальных таблиц значений.4.
Молярная концентрация
Концентрация,
выражаемая через плотность
раствора.Вычисляется с помощью
приборов и специальных таблиц значений.4.
Молярная концентрация
![]() кол-во
молей раств-го вещ-ва в 1ом литре
раст-ра.
кол-во
молей раств-го вещ-ва в 1ом литре
раст-ра.![]() .Моляльная
концентация
.Моляльная
концентация
![]() кол-во
молей раств-го вещ-ва приходится на 1000
грамм раств-ля
кол-во
молей раств-го вещ-ва приходится на 1000
грамм раств-ля![]() Нормальная концентрация
Нормальная концентрация
![]() кол-во
грамм-эквивалентов раств-го вещ-ва
содержится в литре раст-ра
кол-во
грамм-эквивалентов раств-го вещ-ва
содержится в литре раст-ра
![]() Титр – число гр раств-го вещ-ва
в 1 мл раствора.Пример.
Титр – число гр раств-го вещ-ва
в 1 мл раствора.Пример.
![]()
Физические и химические процессы при растворении. Растворимость твердых тел и жидкостей в жидкостях.
Р-рам присущи признаки как химич.(однородность
раствора) соединения, так и механической
(изменение состава р-ра в широких
пределах, а также возможность обнаружения
в св-вах р-ра свойтсв отдельных слагающих
его компонентов) смеси. Физич.теория
растворов (Вант-Гофф).Растворитель
я-ся индифферентной средой, в которой
равномерно размешаны молекулы
растворенного в-ва по всему объему р-ра.
Взаимодействия между чатицами и
молекулами нет. Теория оправдывается
для разбавленных р-ров неэлектролитов.
Химич.теория р-ров (Менделеев).Р-ль
дает с растворенным в-вом определенные
соединения – сольваты. Молекулы
сольватов образуют с растворителем
молекулярную смесь. Причина
образования сольватов – проявление
донорно-акцепторных и водородных связей.
Вокруг ионов располагаются молекулы
растворителя, образуя сольватные слои
(оболочки).Сольваты менее прочны, чем
обычные химические соединения. Легко
разрушаются даже при небольшом повышении
температуры растворов. Растворение
сопровождается выделением/поглощением
теплоты, сокращением/увеличением объема.
Теплота растворения вещества –
кол-во теплоты, поглощаемой (выделяемой)
при растворении одного моля вещества.
Растворимость твердых веществ в
жидкостях. Зависит от природы тв.тел,
природы растворителя и температуры. С
повышением температуры, как правило,
растворимость увеличивается (так как
теплоты растворения имеют отрицат.
значения).Для идеальных р-ров справедливо
уравнение Шредера:
![]() N1 – растворимость
тв.вещ-ва,
N1 – растворимость
тв.вещ-ва,
![]() энтальпия растворения 1 моля вещ-ва в
насыщенном растворе. Растворение
твердого вещества можно представить в
две стадии: плавление вещества и смешение
жидкого вещества с раствором. Тогда
энтальпия смешения равна нулю,
энтальпия растворения 1 моля вещ-ва в
насыщенном растворе. Растворение
твердого вещества можно представить в
две стадии: плавление вещества и смешение
жидкого вещества с раствором. Тогда
энтальпия смешения равна нулю,
![]()
Идеальная растворимость увеличивается с повышением температуры. При понижении температуры происходит выпадение вещества в осадок – процесс кристаллизации. Растворимость жидкостей в жидкостях. Растворимость увеличивается с повышением темп-ры и почти не зависит от давления.Сущ. неограниченная растворимость и растворимость до известного предела.1. жидкости смешиваются в любых пропорциях (спирт и вода).2. имеет место расслаивание (образование двух слоев – верхний и нижний). пример: эфир и вода.Расслаивание умень-ся с ростом темп-ры и исчезает при некоторой (критической) темп-ре.
