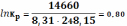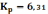- •1. Физико-химические закономерности идеально-газовых реакций. Условия направленности и равновесия.
- •2. Как вычисляют разность стандартных химических потенциалов
- •3. Основные термодинамические закономерности идеально газовых реакций
- •4. Видоизмененные выражения Кр
- •5. Определение Кр расчетным методом Вычисление состава равновесной смеси
- •6. Влияние абсолютного значения и знака ∆g0 на константу равновесия. Границы изменения Кр
3. Основные термодинамические закономерности идеально газовых реакций
С
учетом того, что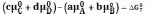 неравенство
(4) уравнения (5), (6), (7) приобретают вид
неравенство
(4) уравнения (5), (6), (7) приобретают вид
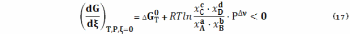
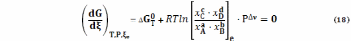
или
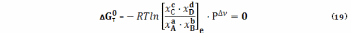
где отношение под знаком логарифма – мольные доли в исходном состоянии (уравнение (17)) и состоянии равновесия.
Уравнения (18), (19) имеют глубокий, но в чем-то неочевидный смысл. Чтобы несколько упростить его выявление, примем, что реакция (1) проходит при Р = 1 атм, что позволяет исключить влияние этого фактора на количество веществ А, В, С, D в состоянии равновесия.
В
исходном состоянии состав реакционной
системы, определяющий мольные доли в
неравенстве (17), был произвольным: 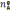 ,
,
,
.
В процессе реакции по мере продвижения
к состоянию равновесия уменьшается
количество реагентов и увеличивается
количество продуктов. Эти изменения
связаны стехиометрическим уравнением
(1), которое справедливо для любого
состава исходной смеси. По этой причине
количество веществ nA,
nB,
nC,
nD
и соответствующие мольные доли в
состоянии равновесия будут зависеть
от состава исходной смеси: каждому
индивидуальному составу исходной смеси
соответствует индивидуальный состав
веществ при равновесии. Но поскольку
одна и та же величина при любом составе
исходной и соответствующей ему равновесной
смеси, величина, равная
,
,
,
.
В процессе реакции по мере продвижения
к состоянию равновесия уменьшается
количество реагентов и увеличивается
количество продуктов. Эти изменения
связаны стехиометрическим уравнением
(1), которое справедливо для любого
состава исходной смеси. По этой причине
количество веществ nA,
nB,
nC,
nD
и соответствующие мольные доли в
состоянии равновесия будут зависеть
от состава исходной смеси: каждому
индивидуальному составу исходной смеси
соответствует индивидуальный состав
веществ при равновесии. Но поскольку
одна и та же величина при любом составе
исходной и соответствующей ему равновесной
смеси, величина, равная

также
является постоянной при данном значении
Т. Это постоянство сохраняется и при
умножении отношения равновесных мольных
долей на сомножитель  ,
Р – произвольное давление. Из постоянства
логарифма величины
,
Р – произвольное давление. Из постоянства
логарифма величины
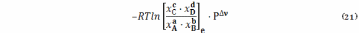
следует, что само отношение под знаком логарифма также постоянная величина. Она обозначается Kp и называется константой химического равновесия идеально газовых реакций.
Таким образом (опуская знак равенства)
С учетом этого, имея в виду уравнения (18), (19)
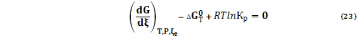
или
= - RTlnKp (24а)
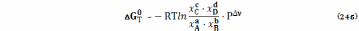
Выражение для константы равновесия (22) можно представить и в более краткой форме
где Рi – парциальные давления в состоянии равновесия.
Подчеркнем еще раз, что термин «константа равновесия» отражает независимость отношений (22) и (25) от состава равновесной смеси, состав которой в свою очередь определяется составом смеси в исходном состоянии.
Попытаемся это важное положение пояснить на примере реакции
2SО2 (г) + О2 (г) = 2SO3 (г) (26)
Примем, что Т = 950К и Р = 1атм.
Пусть в исходном состоянии находится следующее количество (в молях) веществ
Вариант
А:
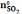 =
1;
=
1;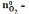 1;
1;
 =
1
=
1
Вариант В: = 2; 1; = 0
Обозначим
через m*
количество
молей SO3,
которое образовалось к моменту наступления
равновесия. Тогда количество SO2,
которое используется на образование
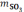 можно найти по правилу пропорциональности:
в соответствие со стехиометрическим
уравнением на образование 2 молей SO3
необходимо 2 моля SO2;
для m
молей SO3
–
y
молей SO2.
можно найти по правилу пропорциональности:
в соответствие со стехиометрическим
уравнением на образование 2 молей SO3
необходимо 2 моля SO2;
для m
молей SO3
–
y
молей SO2.
2 – 2 y – m |
y = m |
что для данного варианта очевидно.
Для O2 аналогичным образом находим**
y = ½ m
В состоянии равновесия (вариант А) имеем
 ;
;
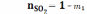 ;
;
Вариант В:
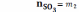 ;
;
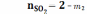 ;
;
Ясно, что из одного моля SO2 и одного моля O2 образуется меньше SO3, чем из двух молей SO2. Даже при полном превращении SO2 в SO3 в первом случае может образоваться лишь 1 моль, во втором – 2 моля.
_______________________
* от лат. «moles» – масса
**При стехиометрическом уравнении
аА + вВ → сС + dD
обозначая количество молей С в состоянии равновесия через m находим:
а – с
yа
– m
y
= m
m
Аналогично
для В и D
находим yВ
= m;
yD
=
m;
yD
= m
m
Итак, m2(В) > m1(А)
тогда
1 – m1 ≠ 2 – m2; 1 – m1 ≠ 1 – m2
m1 ≠ m2
Общее число молей в состоянии равновесия
А:

B:
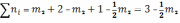
Мольные доли:
А:
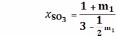 ;
;
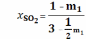 ;
;
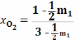
В:
 ;
;
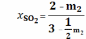 ;
;
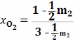
Количество молей и мольные доли в состояниях равновесия, обозначенных А и В различны, но из уравнения (19) следует, что
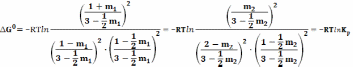
Для реакции (25)(958К) = −14,6 кДж
тогда