- •1. Физико-химические закономерности идеально-газовых реакций. Условия направленности и равновесия.
- •2. Как вычисляют разность стандартных химических потенциалов
- •3. Основные термодинамические закономерности идеально газовых реакций
- •4. Видоизмененные выражения Кр
- •5. Определение Кр расчетным методом Вычисление состава равновесной смеси
- •6. Влияние абсолютного значения и знака ∆g0 на константу равновесия. Границы изменения Кр
1. Физико-химические закономерности идеально-газовых реакций. Условия направленности и равновесия.
Пусть
имеется смесь веществ А, В, С, D,
количество которых в исходном состоянии
равно  ,
,
 ,
,
 ,
,
 .
Вещества А, В, С, D
по свойствам идеальные газы, их смесь
– идеально-газовый раствор. Смесь
находится при температуре Т и общем
давлении Р, которые в дальнейшем
поддерживаются постоянными. В данном
состоянии возможна самопроизвольная
реакция
.
Вещества А, В, С, D
по свойствам идеальные газы, их смесь
– идеально-газовый раствор. Смесь
находится при температуре Т и общем
давлении Р, которые в дальнейшем
поддерживаются постоянными. В данном
состоянии возможна самопроизвольная
реакция
аА + вВ → сС + dD (1)
если
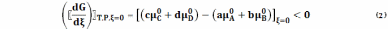
Здесь
 ,
,
 ,
,
 ,
,
 – химические потенциалы соответствующих
веществ в исходном состоянии (ξ=0), состав
которого задается количеством молей
,
,
,
.
В общем случае
– химические потенциалы соответствующих
веществ в исходном состоянии (ξ=0), состав
которого задается количеством молей
,
,
,
.
В общем случае  ,
i
= А, В, С, D
могут быть равны стехиометрическим
коэффициентам или иметь иные значения.
,
i
= А, В, С, D
могут быть равны стехиометрическим
коэффициентам или иметь иные значения.
Из соотношения (2) следует, что GТ,Р – монотонно убывающая функция ξ. Самопроизвольная реакция (1) продолжается до тех пор, пока GТ,Р убывает, и заканчивается наступлением состояния равновесия, в котором GТ,Р имеет минимальное значение (рис.1).
α = 1800 0 ξе 1 ξ tg α1 < 0 tg α0 < 0 
|
Рис. 1. Изменение функции GТ,Р в самопроизвольной реакции; ξе – значение химической переменной в состоянии равновесия*
|
_______________________
* «е» – от сокращенного слова «equilibrium» – равновесие.
На
рис. 1  значение
производной
значение
производной  для
исходного состояния.
для
исходного состояния.
Найдем соотношение (2) в явном виде, воспользовавшись выражением химического потенциала i компонента в идеально газовой смеси:

где
 – парциальные давления веществ А, В, С,
D
в исходном состоянии.
– парциальные давления веществ А, В, С,
D
в исходном состоянии.
После преобразования

Определим
(3) как функцию состава исходной системы,
используя уравнение: 
Количество молей в исходном состоянии
 +
+
+
)
=
+
+
+
)
= 
Тогда

и


Введем
обозначение  ,
,
тогда

или
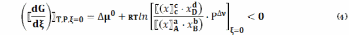
где ∆ν = (c + d) – (a + b)
Величина
 по определению не зависит ни от состава
системы, ни от давления и при данной Т
остается постоянной, при изменении ξ
от нуля до ξе
в состоянии равновесия и от ξе
до
единицы на участке, где прямая реакция
(1) невозможна, но возможен самопроизвольный
процесс в обратном направлении
по определению не зависит ни от состава
системы, ни от давления и при данной Т
остается постоянной, при изменении ξ
от нуля до ξе
в состоянии равновесия и от ξе
до
единицы на участке, где прямая реакция
(1) невозможна, но возможен самопроизвольный
процесс в обратном направлении
сС + dD → aA + bB.
В ходе реакции отношение под знаком логарифма увеличивается, поскольку мольные доли продуктов хC и хD возрастают, а продуктов хА и хВ уменьшаются. В итоге при значении ξ = ξе производная становится равной нулю.
Тогда

где в квадратных скобках – парциальные давления в состоянии равновесия.
Из (5) следует

Обозначим
количество молей i-ого
вещества в состоянии равновесия через
ni.
Тогда общее количество молей 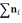 также в состоянии равновесия будет
равно
также в состоянии равновесия будет
равно

Для мольных долей в состоянии равновесия хi имеем

Тогда

Прежде
чем провести дальнейший анализ соотношений
(5) – (7) рассмотрим способы вычисления
изменения стандартных химических
потенциалов,