
- •Конспекты
- •Соединения с открытой цепью
- •I. Углеводороды
- •Номенклатура алканов
- •1.2. Способы получения
- •Химические свойства
- •Алкены (этиленовые углеводороды, олефины)
- •2.1. Строение, изомерия и номенклатура
- •Способы получения
- •Химические свойства
- •Гидратация.
- •3. Галогенирование.
- •4. Гидрогалогенирование.
- •Гипогалогенирование.
- •3. Алкадиены.
- •Методы получения
- •Химические свойства.
- •4. Алкины (ацетиленовые углеводороды).
- •4.1. Методы получения.
- •4.2. Химические свойства.
- •Моногалогенпроизводные алканов.
- •Предельные одноатомные спирты.
- •Многоатомные предельные спирты.
- •Непредельные одноатомные спирты.
- •Альдегиды и кетоны.
- •I. Предельные альдегиды и кетоны.
- •2. Ненасыщенные альдегиды и кетоны.
- •2.1. Оксосоединения с сопряженными двойными связями.
- •2.2. Кетены.
- •3. Диальдегиды и дикетоны.
- •1. Предельные одноосновные кислоты.
- •1.2. Методы получения.
- •1.2. Физические свойства.
- •1.3. Химические свойства.
- •1.3.2. Образование ацилгалогенидов.
- •1.3.3. Образование ангидридов.
- •1.3.4. Этерификация. Сложные эфиры.
- •2. Амины.
- •1.2. Глюкоза.
- •1.3. Другие моносахариды.
- •4.2. Структура целлюлозы.
Химические свойства.
В бутадиене каждый из углеродных атомов sp2 гибридизован. Гибридные орбитали используются на образование связи между углеродами и углеродными и водородными атомами. Оставшиеся вне гибридизации р-электроны образуют вторые связи между С1 и С2 а также между С3 и С4. При этом не исключается и некоторое перекрывание р-орбиталей между С2 и С3:

Все это приводит к некоторому удлинению двойных связей (1,35 вместо 1,34 ангстрема) и укорочению одинарной связи между центральными углеродами (1,46 вместо 1,54 ангстрема). Эта особенность в строении алкадиенов и обуславливает, по-видимому, своеобразие свойств этой группы углеводородов. К этим особенностям алкадиенов относят то, что они: более устойчивы, вступают в 1,4-присоединение, более реакционноспособны, чем алкены.
Большая термодинамическая стабильность диенов с сопряженными двойными связями по сравнению с алкадиенами с изолированными двойными связями следует из следующих данных.
Теплота гидрирования 1,4-пентадиена составляет величину, близкую к ожидаемой – 60,8 ккал/моль (около 30 ккал на каждую двойную связь). При гидрировании же 1,3-пентадиена выделяется лишь 54,1 ккал/моль. Это меньше ожидаемой величины почти на 6 ккал. Если при гидрировании 1,3-пентадиена выделяется меньше энергии, чем при гидрировании 1,4- пентадиена, то это означает, что он сам содержит меньше энергии и, следовательно, более устойчив, чем углеводород с изолированными двойными связями.
1. Электрофильное присоединение. Диеновые углеводороды с сопряженными двойными связями вступают во все реакции, характерные для алкенов. Так, бутадиен реагируют с последовательным вовлечением в реакцию двойных связей с бромом:
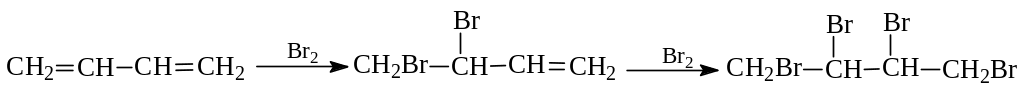
Однако неожиданно в продуктах монобромирования оказывается не только 3,4-дибром-1-бутен, но и 1,4-дибром-2-бутен:
![]()
Это соединение может получиться, если бром атакует диен по концам сопряженной системы двойных связей с перемещением одной из них к центру молекулы. Такое направление реакции и называется 1,4-присоединением.
Для объяснения 1,4-присоединения рассмотрим гидрохлорирование 2,4-гексадиена. В соответствии с предложенным механизмом электрофильного присоединения к С=С связи (см. химические свойства алкенов) гексадиен в медленной элементарной стадии будет протонироваться. При этом в зависимости от атаки по второму или третьему углероду возможно образование различных карбокатионов:
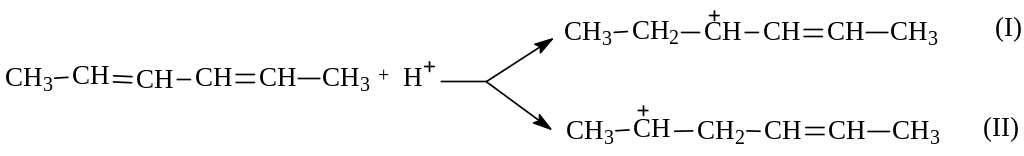
Известно, что ионное присоединение обычно протекает с промежуточным образованием более стабильного карбокатиона. Причем, об устойчивости алкильных карбокатионов можно судить по тому, являются ли они первичными, вторичными или третичными. В рассматриваемом случае оба карбокатиона оказались вторичными. Какой же из них более устойчив?
При внимательном рассмотрении карбокатионов (I) и (П) обнаруживается, что они заметно отличаются по строению: (I) относят к ионам аллильного типа.
Образование самого аллильного катиона можно представить следующим образом. Затратив энергию диссоциации (77 ккал), можно осуществить гомолиз связи С-Н в метильной группе пропилена с получением аллильного радикала. Потенциал ионизации этого радикала составляет 188 ккал. Следовательно, для получения аллильного карбокатиона из пропилена надо затратить в сумме 265 ккал:
![]()
Для сравнения напомним, что трет.бутильный катион получается из изобутана с затратой 262 ккал. Отсюда видно, что аллильный катион, хотя он и первичный, однако не уступает третичному по устойчивости. Причина этого кроется в том, в аллильном катионе электронодефицитный углерод расположен рядом с двойной связью. Электроны двойной связи принимают настолько активное участие погашении заряда у этого углерода, что один из р-электронов вообще переходит к нему, обнажив положительный заряд у другого углерода:
![]()
В результате происходит эффективная делокализация (рассредоточение) заряда таким образом, что он принадлежит уже не к одному конкретному углероду, а ко всей аллильной системе:

Вернемся к карбокатиону (I). В свете изложенного выше понятно, что этот катион аллильного типа можно написать в виде структуры (Ш):
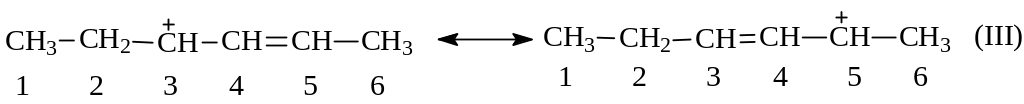
Видно, что при стабилизации иона нуклеофильная атака анионом хлора возможна на С3 в (I) и в результате будет иметь место 1,2-присоединение; при атаке же на С5 в (Ш) будет наблюдаться 1,4-присоединение:
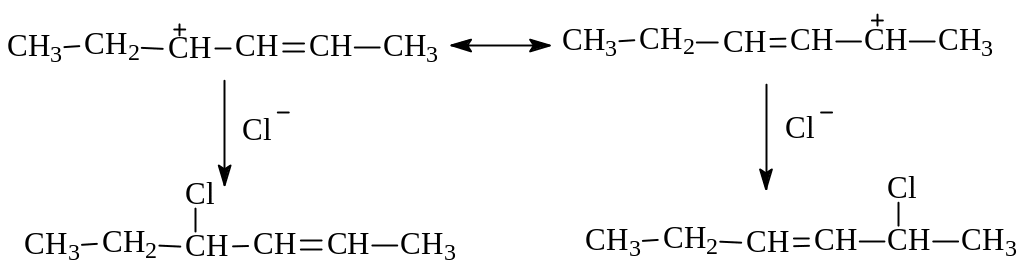
Таким образом, образование при электрофильном присоединении к алкадиенам в качестве промежуточной частицы устойчивого катиона аллильного типа объясняет как высокую реакционную способность этих непредельных углеводородов, так и возможность реакций 1,2- и 1,4-присоединения.
Пойдет ли реакция как 1,2- или 1,4-присоединение зависит от условий ее проведения. Например, при бромировании бутадиена в более мягких условиях (-800) образуется больше продукта 1,2-присоединения; при +400 превалирует продукт 1,4-присоединения. Понятно, что 1,2-присоединение происходит быстрее, чем 1,4-присоединение. В мягких условиях проведения реакции соотношение продуктов 1,2- и 1,4-присоединения отражает скорости их образования. В этом случае первый из них называют кинетически контролируемым продуктом реакции. С ужесточением условий проведения реакции состав продуктов определяется в соответствии с их термодинамической устойчивостью. Поэтому 1,4-аддукт называют термодинамически контролируемым продуктом реакции.
2. Полимеризация. Как и моноолефины, диеновые углеводороды с сопряженными двойными связями способны полимеризоваться за счет двойных связей. В случае несимметричных диенов (изопрена) полимеризация может протекать как 1,2-, 3,4- или же 1,4-присоединение с встраиванием в полимерную цепочку следующих фрагментов в любых сочетаниях:
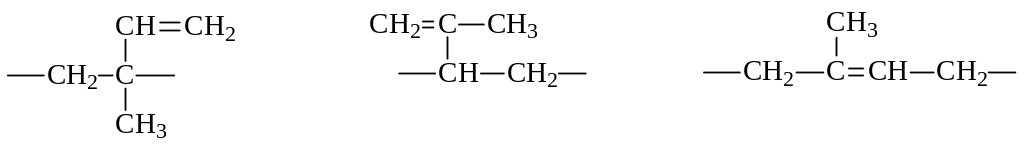
К тому же фрагменты могут присоединяться по типу «голова к хвосту» или наоборот. Наконец, в полученном полимере, представляющем собой полиолефин, возможно проявление цис- и транс-изомерии. Понятно, что если процесс полимеризации как-то не регулировать, полимер будет представлять собой хаотическое сочетание всех вышеуказанных фрагментов. А это, в свою очередь, скажется на свойствах полимера. А насколько строение влияет на свойство, может быть продемонстрировано на примере цис-1,4-полиизопрена и транс-1,4-полиизопрена:

Натуральный каучук имеет строение цис-1,4-полиизопрена, а транс-изомер – это гуттаперча, который также является натуральным продуктом.
Получение цис-1,4-полиизопрена из изопрена долгое время казалась неразрешимой проблемой, пока не была разработана каталитическая система на основе триалкилалюминия и галогенидов переходных металлов (катализаторы Циглера – Натта), позволяющая осуществлять т.н. стереорегулярную полимеризацию.
Большое значение имеют и бутадиеновые каучуки, получаемые полимеризацией дивинила в присутствии натрия. Еще в начале 40-ых годов прошлого столетия впервые в мире промышленное производство этого каучука было организовано в СССР. В настоящее время широко используются и сополимеры бутадиена с другими мономерами, например, со стиролом. Все перечисленные виды каучуков относят к каучукам общего назначения, используемым при производстве массовых резинотехнических изделий.
Прекрасным конструкционным материалом каучук стал после открытия процесса вулканизации (Гудьир, 1839 г.). Было установлено, что после нагревания с серой (около 8%) и внесения наполнителей (сажа) каучук превращается в нелипкий и эластичный эластомер. При вулканизации сера связывает между собой полимерные цепи. Реакция идет за счет двойных связей и по аллильному положению:
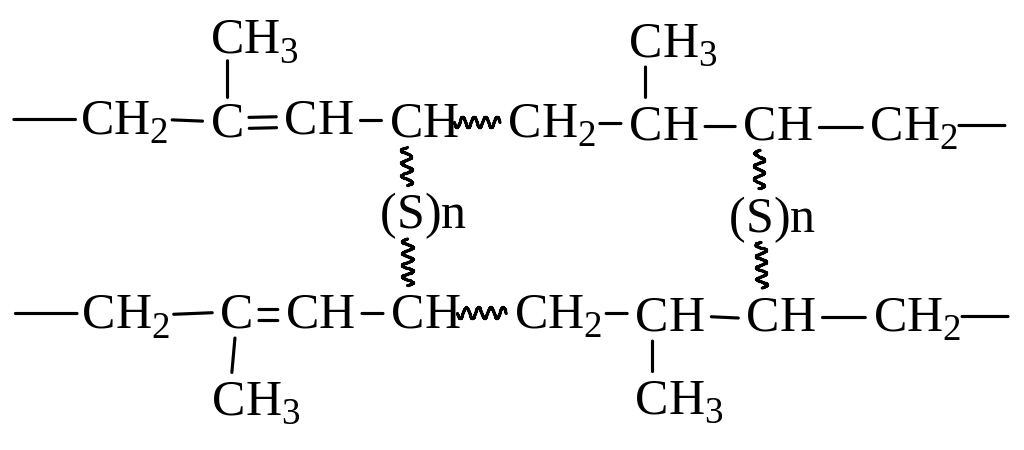
3. Реакция Дильса - Альдера. Реакция 1,4-присоединения к алкадиенам ненасыщенных соединений с активированной двойной связью носит название реакции Дильса-Альдера или реакции диенового синтеза. Реакция была открыта в 1929 году на примере взаимодействия бутадиена с малеиновым ангидридом:
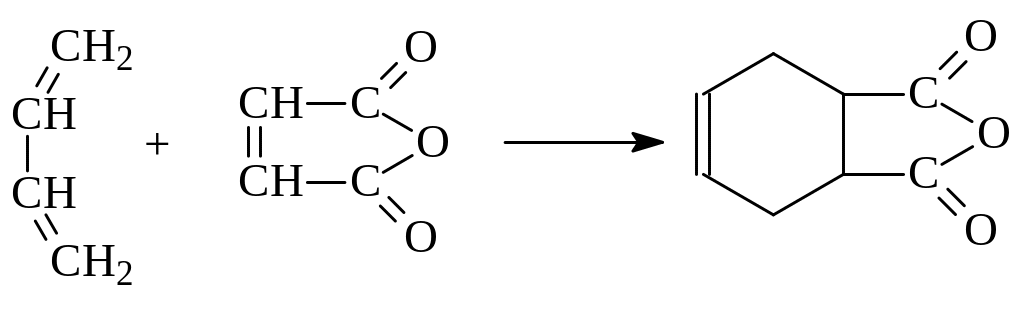
Соединения, реагирующие с диенами в реакции Дильса-Альдера, называются диенофилами. Наиболее активными диенофилами являются алкены, у которых двойная связь сопряжена с электроноакцепторными группами (СНО, СООН, СN, NO2 и др.). В то же время наиболее реакционноспособные в этой реакции диены содержат при двойной связи электронодонорные группы.
Механизм реакции Дильса-Альдера не вполне ясен. Во всяком случае в ходе этой реакции не получаются уже рассмотренные нами активные частицы – радикалы и ионы. Чтобы образовалась молекула аддукта реакции диенового синтеза, необходим разрыв двух -связей в диене и еще одной -связи в диенофиле; в то же время возникают две новые -связи и одна -связь в молекуле продукта реакции. Предполагают, что все это происходит одновременно в шестичленном активированном переходном комплексе.
Диеновый синтез широко используется для качественного и количественного определения алкадиенов, а также в органическом синтезе.
