
- •Конспекты
- •Соединения с открытой цепью
- •I. Углеводороды
- •Номенклатура алканов
- •1.2. Способы получения
- •Химические свойства
- •Алкены (этиленовые углеводороды, олефины)
- •2.1. Строение, изомерия и номенклатура
- •Способы получения
- •Химические свойства
- •Гидратация.
- •3. Галогенирование.
- •4. Гидрогалогенирование.
- •Гипогалогенирование.
- •3. Алкадиены.
- •Методы получения
- •Химические свойства.
- •4. Алкины (ацетиленовые углеводороды).
- •4.1. Методы получения.
- •4.2. Химические свойства.
- •Моногалогенпроизводные алканов.
- •Предельные одноатомные спирты.
- •Многоатомные предельные спирты.
- •Непредельные одноатомные спирты.
- •Альдегиды и кетоны.
- •I. Предельные альдегиды и кетоны.
- •2. Ненасыщенные альдегиды и кетоны.
- •2.1. Оксосоединения с сопряженными двойными связями.
- •2.2. Кетены.
- •3. Диальдегиды и дикетоны.
- •1. Предельные одноосновные кислоты.
- •1.2. Методы получения.
- •1.2. Физические свойства.
- •1.3. Химические свойства.
- •1.3.2. Образование ацилгалогенидов.
- •1.3.3. Образование ангидридов.
- •1.3.4. Этерификация. Сложные эфиры.
- •2. Амины.
- •1.2. Глюкоза.
- •1.3. Другие моносахариды.
- •4.2. Структура целлюлозы.
4. Гидрогалогенирование.
Реакция присоединения к алкенам галогенводородных кислот приводит к моногалогенпроизводным алканов:
![]()
Гидрогалогенирование проводится без использования растворителя или же в растворителе средней полярности (уксусная кислота), но не в воде (возможна гидратация).
Галогенводородные кислоты по реакционной способности по отношению к алкенам располагаются в следующий ряд:
![]()
Фтористый водород наряду с присоединением к алкену часто вызывает его полимеризацию.
Гидрогалогенирование алкенов – типичная реакция электрофильного присоединения. На первой стадии происходит протонирование молекулы олефина в направлении образования более устойчивого карбокатиона (правило Марковникова), который далее быстро присоединяет анион галогена с образованием продукта реакции:
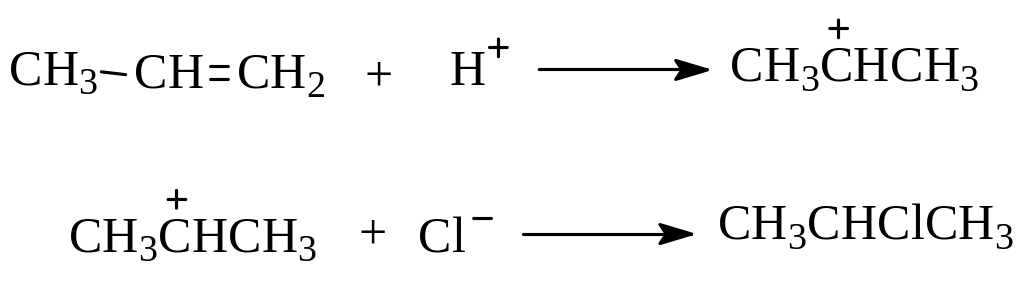
Иногда гидрогалогенирование протекает против правила Марковникова. Оказалось, что это происходит при гидробромировании в присутствии перекисей (перекисный эффект Хараша, 1933). В этом случае реакция идет не по ионному, а по радикальному механизму (см. радикальное присоединение к алкенам).
Гипогалогенирование.
Присоединение к алкену гипогалогенитных кислот носит название реакции гипогалогенирования. При этом получаются соединения, содержащие атом галогена и гидроксильную группу у соседних атомов углерода – галогенгидрины:
![]()
Направление реакции определяется правилом Марковникова в следующей трактовке: при гипогалогенировании алкенов атом галогена направляется к наиболее гидрогенизированному атому углерода двойной связи:
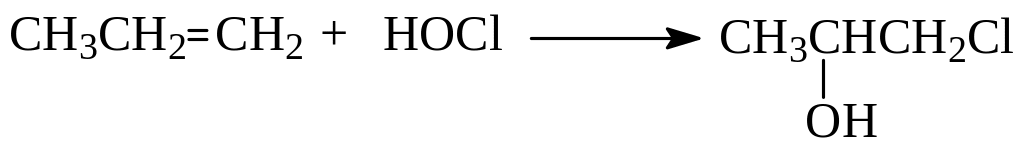
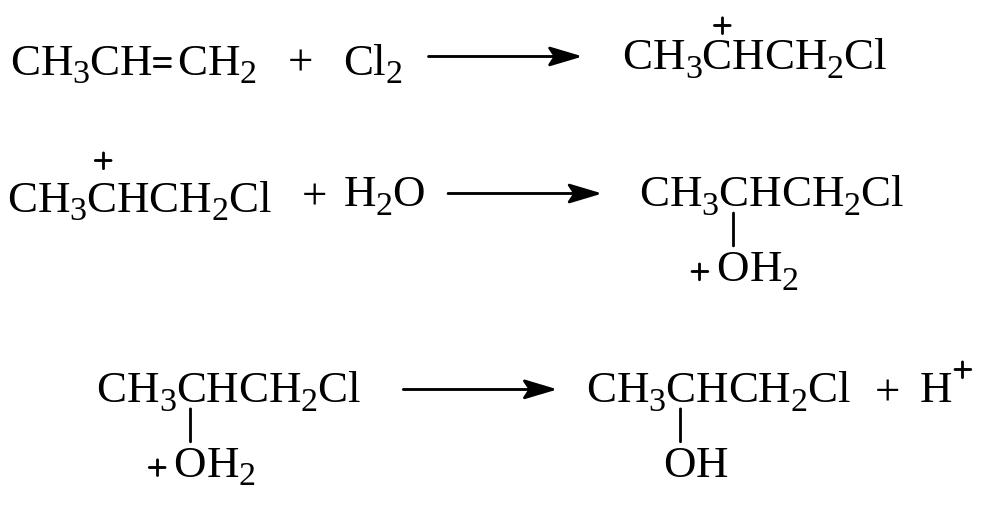
При гипогалогенировании необязательно использование самих кислот. Можно использовать галоген и воду.
Механизм реакции включает стадию образования наиболее устойчивого карбокатиона и стадию присоединения последним молекулы воды:
Присоединение альдегидов (реакция Принса).
В определенных условиях этиленовые углеводороды способны присоединять молекулы альдегидов с образованием шестичленных гетероциклических соединений с двумя кислородами в кольце. На примере изобутилена и формальдегида возможный механизм электрофильного присоединения в этом случае представляется следующим:
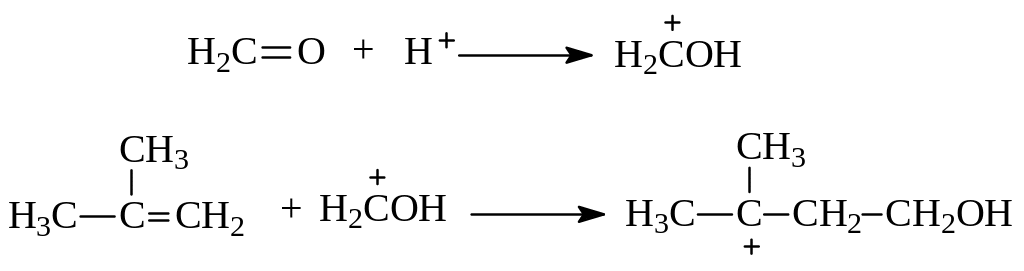
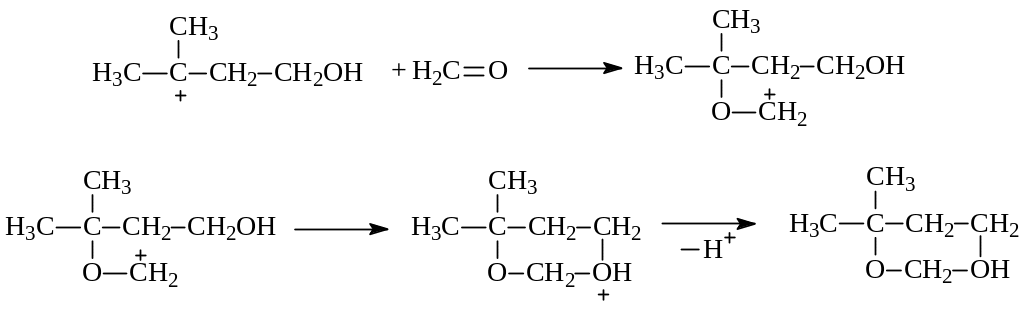
Электрофильная частица возникает при протонировании молекулы альдегида. Далее происходит электрофильная атака алкена в направлении образования наиболее устойчивого карбокатиона, нуклеофилом к которому выступает другая молекула альдегида. Реакция завершается внутримолекулярной циклизацией и отщеплением протона.
В реакции лучшие результаты получены с участием формальдегида и ацетальдегида. Этилен в реакцию Принса вовлечь не удалось. Другие алкены формальдегид (в виде формалина – 36% - ного водного раствора) присоединяют без затруднений. В промышленном масштабе конденсацией изобутилена с формальдегидом получают 4,4-диметил-1,3-диоксан – промежуточный продукт при получении важнейшего мономера современной промышленности синтетического каучука изопрена:
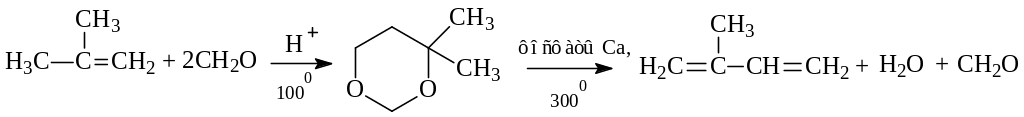
7. Присоединение алкенов (димеризация, полимеризация).
При нагревании изобутилена в присутствии серной кислоты Бутлеров наблюдал образование продуктов, состоящих из 8- и 12 атомов углерода, т.е. димеризацию и тримеризацию изобутилена. Среди соединений, входящих в состав димеров, преобладали 2,4,4-триметил-1-пентен и 2,4,4-триметил-2-пентен:
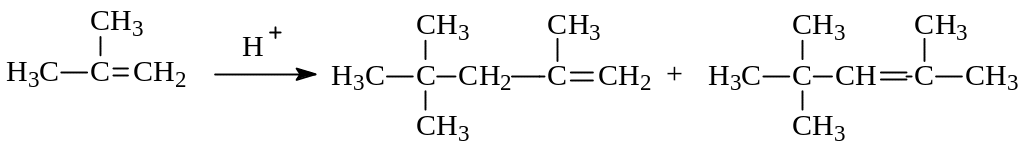
Образование именно этих соединений легко объясняется в рамках механизма электрофильного присоединения к кратной углерод-углеродной связи:
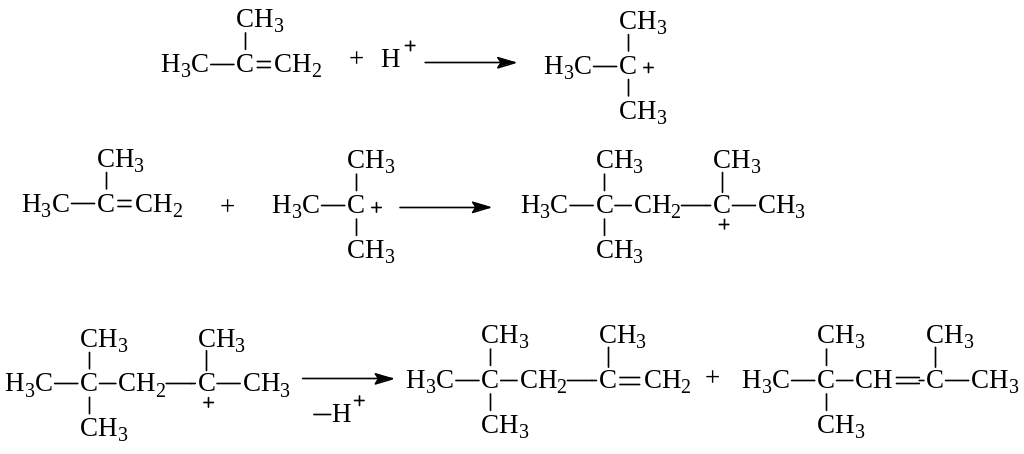
Вначале происходит протонирование алкена с образованием более устойчивого карбокатиона – трет.бутильного. Катион далее присоединяется к еще одной молекуле изобутилена. При этом также получается наиболее стабильный димерный карбокатион. Судя по строению продуктов реакции, этот ион отщепляет протон от одного из соседних углеродов и превращается в продукты димеризации. Кроме этого направления реакции, димерный карбокатион, как и его предшественник, может присоединяться к следующей молекуле изобутилена. Если такое направление реакции будет повторяться многократно, то получится продукт (полимер), состоящий из многих остатков исходного алкена (мономера). Образование полимера из многих молекул мономера называется полимеризацией.
К полимеризации способны все алкены. Труднее всего среди непредельных углеводородов полимеризуется этилен. Для этого требуется 2000, очень высокое давление – свыше 1500 атм., и присутствие следов кислорода. Полимеризация в этом случае носит цепной радикальный характер:
![]()
![]()
Вплоть до обрыва цепи, который когда-нибудь случается, например, из-за рекомбинации, растущая частица остается радикалом. Следует заметить, что полимеризация в общем случае может протекать и по ионному механизму – карбокатионному или карбанионному.
К.Циглер обнаружил, что полимеризацию этилена можно осуществить в несравненно мягких условиях при использовании каталитической системы, состоящей из триэтилалюминия (триалкилалюминия) и четыреххлористого титана (галогенидов металлов переменной валентности). Для сравнения с условиями полимеризации при высоком давлении, приведем условия полимеризации этилена по Циглеру: 56 – 700, 0 – 7 атм. Образование т.н. полиэтилена низкого давления в этом случае идет как постепенное внедрение молекул этилена по связи между алюминием и этильным радикалом:
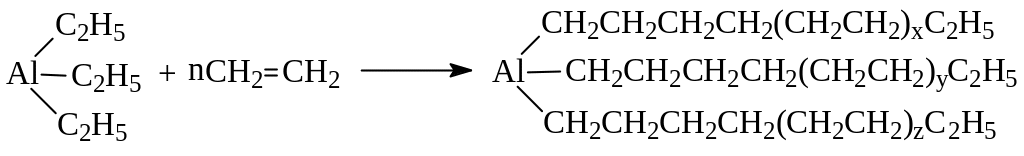
Процесс завершается распадом образовавшегося триалкилалюминия:
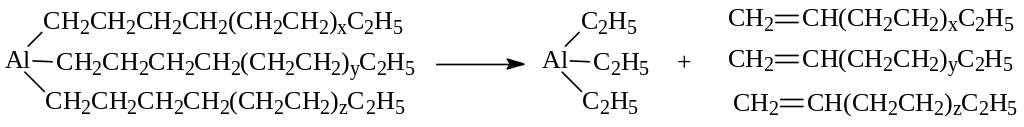
Алкилирование.
При взаимодействии алкенов с алканами в молекулу последних вводится алкильный радикал – происходит т.н. реакция алкилирования. Реакция между изобутиленом и изобутаном в присутствии серной или фосфорной кислот приводит к 2,4,4-триметилпентану (изооктану), являющемуся ценным компонентом моторных топлив. Ход реакции в этом случае, протекающей как электрофильное присоединение, можно представить следующим механизмом:
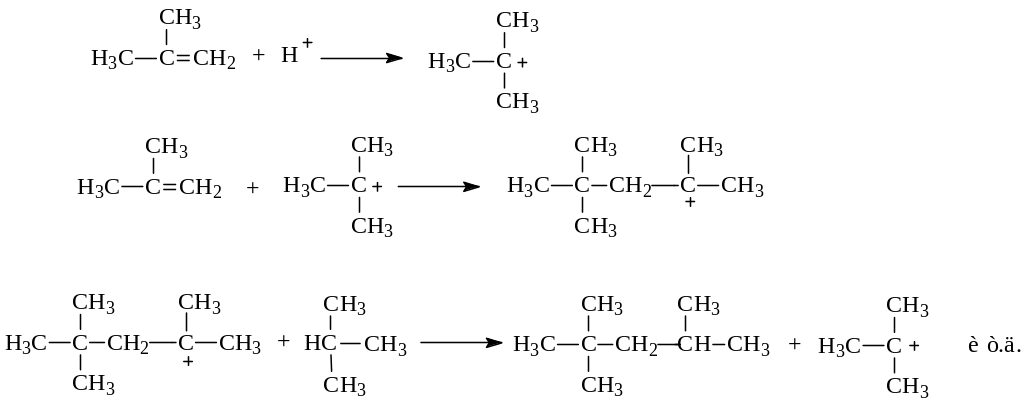
Своеобразие алкилирования заключается в способе стабилизации карбокатиона. В данном случае свое стремление получить пару электронов и заполнить электронную оболочку до октета карбокатион реализует путем отрывания гидридиона от молекулы предельного углеводорода.
Алкилирование – эффективный способ получения алканов разветвленного строения, представляющих интерес как высокооктановое моторное топливо.
9. Оксосинтез (гидроформилирование).
Реакция присоединения к этиленовым углеводородам оксида углерода и водорода с получением альдегидов называется оксосинтезом (Реппе). Реакция проводится при 100 – 2000, под давлением 100 – 200 атм. в присутствии кобальтового или никелевого катализатора. Активным началом кобальтового катализатора является гидрокарбонил кобальта НСо(СО)4.
В промышленности реализован оксосинтез пропилена с целью получения масляного альдегида:
![]()
В качестве побочного продукта в этом процессе получается изомасляный альдегид с выходом до 25%.
Действительный механизм оксосинтеза не установлен.
10. Присоединение карбена.
Карбен – реакционная частица :СН2, существующая в двух различных формах. В одной из них два внешних электрона спарены и находятся на общей орбитали. Такой метилен называется синглетным (:СН2). В другой форме свободные электроны не спарены, каждый из них находится на собственной орбитали. Этот бирадикальный метилен называется триплетным.
Вследствие дефицита электронов, а углерод в метилене окружен лишь шестью электронами, карбены относятся к электрофильным активным частицам и способны присоединяться к алкенам (и синглетный, и триплетный) с образованием производных циклопропана:
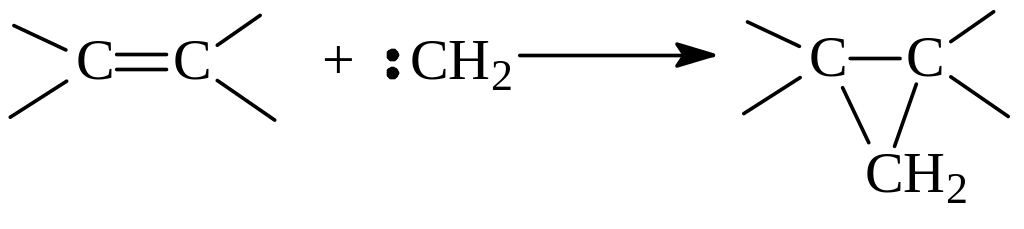
Имея в виду природу образующихся продуктов, присоединение карбена к алкенам часто называют циклопропанированием.
Метилен (синглетный) образуется при фотолизе диазометана, а часто применяемый при циклопропанировании дихлоркарбен :ССl2 легко получается при взаимодействии хлороформа с сильным основанием:
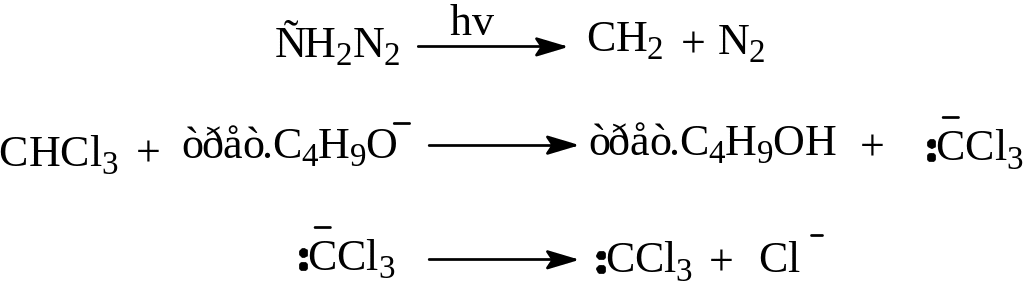
Б. Реакции радикального присоединения.
1. Гидробромирование. Механизм радикального присоединения к алкенам был предложен Харашом и Майо еще в 1933 году для объяснения результатов присоединения бромистого водорода к алкенам против правила Марковникова:
![]()
Такое направление присоединения наблюдается в присутствии перекисей, образующих в условиях реакции радикалы. Эти радикалы вызывают гомолиз бромистого водорода с образованием атомарного брома. При атаке этой частицей молекулы алкена образуется более устойчивый радикал, который в последующей быстрой стадии осуществляет гомолитическое расщепление молекулы галогенводорода. При этом получается продукт реакции и радикал брома, продолжающий цепь превращений:
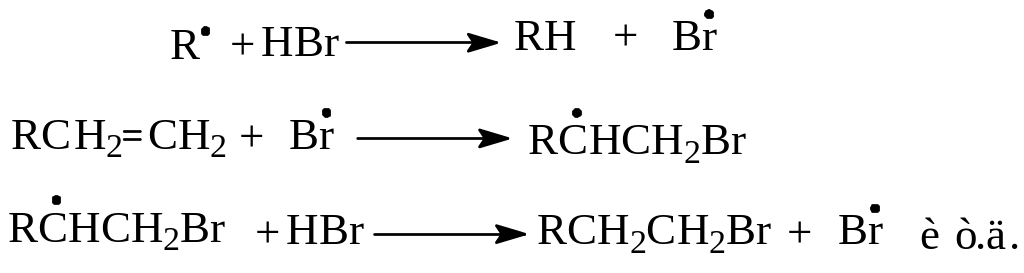
Интересно отметить, что если ионное присоединение к алкенам протекает через промежуточное образование наиболее устойчивого карбокатиона, то гомолитическое присоединение также идет через наиболее стабильную частицу – радикал.
2. Присоединение четыреххлористого углерода. Другим примером радикального присоединения к алкенам является реакция между четыреххлористым углеродом и этиленовым углеводородом при освещении ультрафеолетом. Предполагается, что инициирование освещением вызывает гомолиз одной из связей С-Сl с образованием трихлорметильного радикала, который далее атакует двойную связь в направлении возникновения устойчивого радикала:
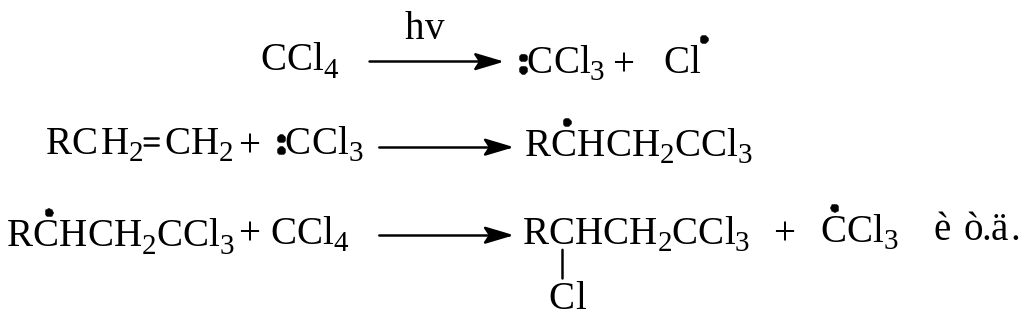
Продукты этой реакции представляют большую ценность при синтезе непредельных-, окси- и аминокислот, поскольку трихлорметильная группа легко гидролизуется в карбоксил, а атом галогена вступает в различные реакции замещения и в реакцию элиминирования.
В. Радикальное замещение.
Поскольку в состав молекулы алкенов входят и алкильные остатки, то они могут реагировать и с их участием. Понятно, что это будут изученные нами реакции свободнорадикального замещения. Однако эти реакции будут конкурировать с реакциями радикального или ионного присоединения. При этом кажется, что реакция присоединения полностью подавит замещение, поскольку она протекает в несравнимо мягких условиях. Как это ни удивительно, были найдены условия, при которых в основном идет замещение. Так, при хлорировании пропилена при 500 - 6000 получается не 1,2-дихлорпропан, а хлористый аллил:
![]()
Для объяснения результатов высокотемпературного хлорирования было предположено (Браун), что и при высокой температуре атом хлора присоединяется с образованием соответствующего радикала. Однако для этого радикала скорость вступления во вторую стадию свободнорадикального присоединения гораздо меньше, чем скорость отщепления уже присоединившегося галогена. В результате реакция присоединения не доходит до конца, т.е. до получения дигалогенпроизводного. В то же время развитию реакции свободнорадикального замещения через аллильный радикал ничего не препятствует:
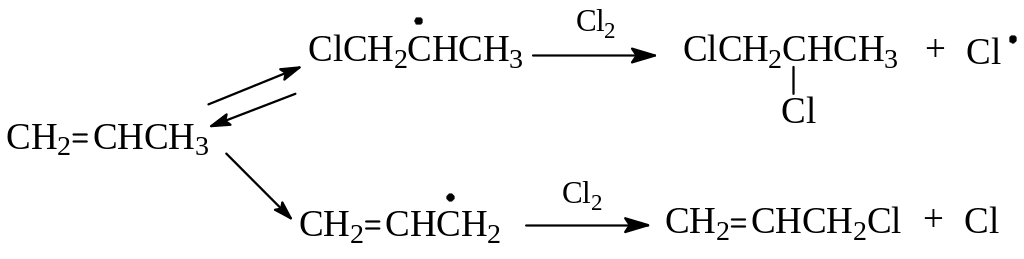
Заместительное (аномальное) хлорирование пропилена используется в промышленности для получения хлористого аллила – промежуточного продукта в синтезе глицерина.
Другие реакции алкенов.
Кроме рассмотренных реакций, алкены способны к превращениям еще по многим другим направлениям.
1. Гидрирование. Присоединение водорода по кратной связи алкенов приводит к предельным углеводородам:
![]()
Наиболее активными катализаторами гидрирования являются платина, палладий или рутений в тонко диспергированном виде. Эти катализаторы настолько активны, что реакция может протекать уже при 25 – 900 при небольшом давлении. Такой же активностью обладает катализатор «никель Ренея», получаемый из сплава никеля с алюминием обработкой щелочью. При этом щелочь растворяет алюминий, а никель приобретает сильно развитую поверхность. Имеется целая группа более дешевых катализаторов: медь, кобальт, железо, хромит меди. При использовании этих катализаторов реакцию приходится проводить при 150 – 2500 и давлениях 200 – 350 атм.
Гидрирование алкенов едва ли имеет практическое значение (гораздо более актуальна обратная задача получения алкенов из алканов из-за их доступности) и представляет некоторый интерес для аналитических целей и при изучении устойчивости олефиновых углеводородов.
При гидрировании разрывается -связь молекулы алкена (для этого требуется затратить около 60 ккал) и связь между атомами водорода (энергия этой связи 104 ккал). Общие затраты энергии составят 164 ккал. В то же время происходит образование двух С-Н связей с выделением 97х2=194 ккал. Отсюда следует, что гидрирование – процесс экзотермический, протекающий с выделением около 30 ккал на каждую двойную связь. Количество тепла, выделяющееся при гидрировании одного моля алкена, называется теплотой гидрирования.
Теплоты гидрирования алкенов хотя и близки к указанным 30 ккал, однако различаются между собой. Связь между строением этиленового углеводорода и теплотой гидрирования дает ценную информацию об относительной устойчивости алкена. В качестве примера укажем теплоты гидрирования некоторых алкенов:
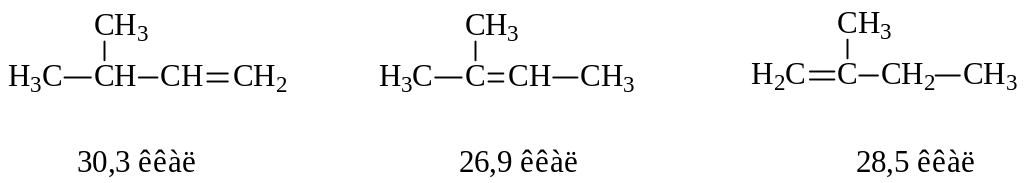
Все эти изопентены при гидрировании дают один и тот же изопентан. Следовательно, различие в теплотах гидрирования обусловлено их неодинаковой устойчивостью. Систематическое изучение связи между строением алкена и его теплотой гидрирования позволило установить, что чем больше степень замещения при двойной связи, тем устойчивее алкен. Алкены по уменьшению устойчивости располагаются в следующий ряд:
![]()
Выявление указанной закономерности имеет большое значение, поскольку позволяет предсказать направление реакций элиминирования (соблюдение правила Зайцева при дегидратации и дегидрогалогенировании), протекающих с образованием наиболее замещенных алкенов.
2. Окисление. При окислении алкенов, в зависимости от условий проведения реакции и природы окислителя, получаются разнообразные кислородсодержащие соединения. Рассмотрим некоторые варианты окисления алкенов.
а) При окислении алкенов гидроперекисями ацилов (надкислотами) получаются эпоксиды (реакция Прилежаева):

Однако промышленный синтез некоторых важнейших эпоксидов основан на высокотемпературном окислении алкенов кислородом воздуха в присутствии серебряного катализатора. В частности, так получают окись этилена в основном используемый для синтеза этиленгликоля:
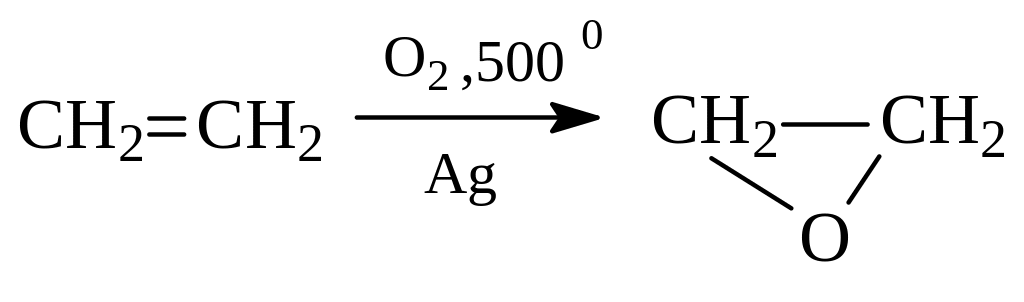
б) Обычные окислители превращают алкены в вицинальные двухатомные спирты – гликоли (реакция Вагнера). В результате окисления этилена разбавленным раствором перманганата калия образуется этиленгликоль:
![]()
Для гидроксилирования алкенов, кроме указанного окислителя, используют надмуравьиную кислоту, перекись водорода в присутствии катализаторов (оксиды осьмия, хрома и др.).
в) В некоторых случаях окисление алкенов протекает с полным разрушением двойной связи. Получающиеся при этом фрагменты дают карбоновые кислоты и кетоны:
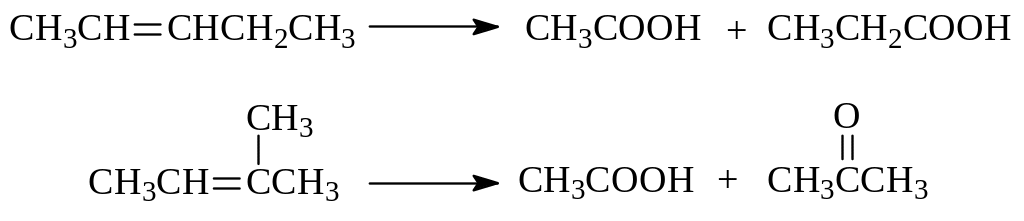
Так окисление идет при использовании концентрированных растворов сильных окислителей: перманганата калия, хромовой кислоты, азотной кислоты. По продуктам окисления можно судить о строении алкенов.
г) Озонолиз. Под озонолизом понимают окисление алкенов с расщеплением двойной связи под действием озона (реакция Гарриеса). Продуктами реакции являются альдегиды и кетоны. Если не принять меры, альдегиды могут окисляться дальше до карбоновых кислот.
Озонолиз алкенов протекает в две стадии - вначале получаются неустойчивые озониды, которые при взаимодействии с водой дают карбонильные соединения и перекись водорода:
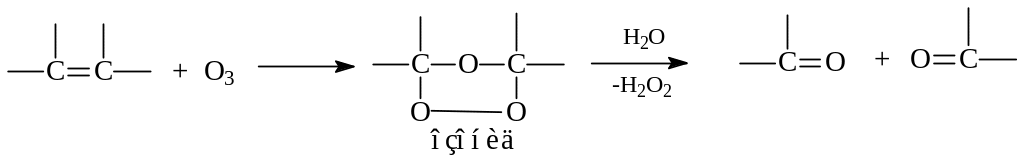
Озонирование алкенов часто используется при установлении их строения. Если известно, например, что в результате озонолиза получены ацетон и изомасляный альдегид:
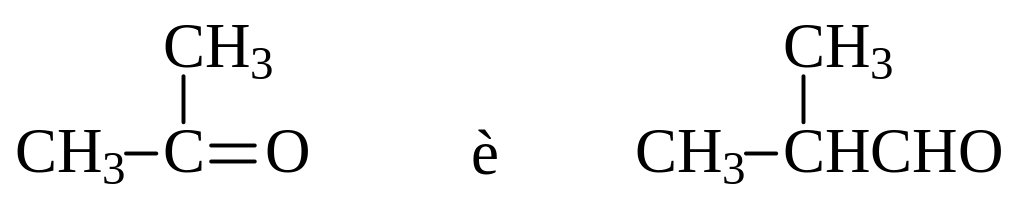
то они могли образоваться только из 2,4-диметил-2-пентена.
