
- •Конспекты
- •Соединения с открытой цепью
- •I. Углеводороды
- •Номенклатура алканов
- •1.2. Способы получения
- •Химические свойства
- •Алкены (этиленовые углеводороды, олефины)
- •2.1. Строение, изомерия и номенклатура
- •Способы получения
- •Химические свойства
- •Гидратация.
- •3. Галогенирование.
- •4. Гидрогалогенирование.
- •Гипогалогенирование.
- •3. Алкадиены.
- •Методы получения
- •Химические свойства.
- •4. Алкины (ацетиленовые углеводороды).
- •4.1. Методы получения.
- •4.2. Химические свойства.
- •Моногалогенпроизводные алканов.
- •Предельные одноатомные спирты.
- •Многоатомные предельные спирты.
- •Непредельные одноатомные спирты.
- •Альдегиды и кетоны.
- •I. Предельные альдегиды и кетоны.
- •2. Ненасыщенные альдегиды и кетоны.
- •2.1. Оксосоединения с сопряженными двойными связями.
- •2.2. Кетены.
- •3. Диальдегиды и дикетоны.
- •1. Предельные одноосновные кислоты.
- •1.2. Методы получения.
- •1.2. Физические свойства.
- •1.3. Химические свойства.
- •1.3.2. Образование ацилгалогенидов.
- •1.3.3. Образование ангидридов.
- •1.3.4. Этерификация. Сложные эфиры.
- •2. Амины.
- •1.2. Глюкоза.
- •1.3. Другие моносахариды.
- •4.2. Структура целлюлозы.
1.2. Глюкоза.
Важнейшим из многих десятков известных на сегодня моносахаридов является глюкоза. Сотни миллиардов тонн глюкозы ежегодно синтезируются зеленой растительностью в процессе фотосинтеза. Поэтому установление строения этого моносахарида представляет собой задачу исключительной важности.
Элементный состав глюкозы выражается формулой С6Н12О6. Результаты исследования некоторых свойств моносахарида показывают:
- глюкоза дает производные с гидроксиламином, фенилгидразином; бромной водой окисляется до глюконовой, а азотной кислотой – до глюкаровой кислоты. Все это свидетельствует о присутствии в молекуле глюкозы альдегидной группы.
- при этерификации уксусным ангидридом глюкоза дает пентаацетат. Отсюда следует, что в ее молекуле имеется пять гидроксильных групп. Причем они рассредоточены у пяти углеродов, поскольку один углерод не может содержать два гидроксила.
- при восстановлении глюкозы образуется шестиатомный спирт – сорбит, который при дальнейшем восстановлении иодистоводородной кислотой дает 2-иодгексан. Следовательно, все шесть углеродов в глюкозе построены линейно.
Таким образом, глюкоза представляет собой неразветвленный пентаоксиальдегид с шестью атомами углерода – альдогексозу

При внимательном рассмотрении приведенной структурной формулы, устанавливающей порядок связей различных атомов друг с другом видно, что она весьма приблизительна. В молекуле глюкозы имеется четыре асимметрических атома углерода, при каждом из которых возможно различное пространственное расположение атомов (конфигурация) водорода и гидроксильных групп при сохранении порядка связей в молекуле. Известно, что число стереоизомеров с числом асимметрических атомов углерода (n) связаны соотношением 2n. Следовательно, формулу, которая была выведена исходя из свойств глюкозы, могут иметь 24=16 (!) пространственных изомеров и только один из них принадлежит глюкозе. Какой же из этих 16 изомеров отображает глюкозу? Перед такой проблемой встретился выдающийся немецкий химик Эмиль Фишер в 1889 году, когда он начал свои исследования по установлению строения глюкозы. В работе Фишера поражает исключительная рациональность методов исследования. Для установления строения глюкозы, для определения конфигурации при каждом из четырех асимметрических центров, Фишеру хватило уменья окислять углевод азотной кислотой и пользоваться поляриметром для обнаружения оптической активности моносахарида. Через три года проблема была решена.
1.2.1 Строение (+)-глюкозы* по Фишеру.
Прежде всего, Фишер графически изобразил упомянутые выше 16 стереоизомерных альдогексоз, располагая в различных сочетаниях водородные и гидроксильные группы при каждом из четырех асимметрических углеродов. До рассмотрения доказательства Фишера следует определиться с написанием формулы конфигурационных изомеров. Конечно, лучше всего было бы изобразить все асимметрические атомы углерода в соединении в тетраэдрической форме, однако сделать это нелегко. Выход из положения указал сам Фишер, вместо громоздких тетраэдрических углеродов он предложил пользоваться их проекциями на плоскости. Такие формулы называются проекционными формулами Фишера. Для примера приведем проекционные формулы энантиомерных глицериновых альдегидов НОСН2СН(ОН)СНО

Для (+)-глицеринового альдегида, в молекуле которого гидроксил при хиральном углероде расположен справа, было предложено использовать обозначение D в названии. Левовращающий энантиомер этого альдегида получил обозначение L. Следует подчеркнуть, что обозначения D и L не
*) Знаки (+) и (-) означают направление вращения поляризованного луча. Если вращение по часовой стрелке, то (+).
имеют отношения к направлению вращения изомера, ими обозначаются конфигурации при асимметрическом атоме углерода. Отметим также, что во времена Фишера невозможно было установить так называемые абсолютные конфигурации и увязать направление вращения поляризованного луча с конфигурационным строением соединения. Правовращающим энантиомером глицеринового альдегида мог оказаться как D, так и L изомер. Поэтому без всяких оснований было принято глицериновый альдегид с правым расположением гидроксила при асимметрическом углероде обозначить как D-изомер, а другой энатиомер как L-изомер. Через более чем 50 лет оказалось, что конфигурации глицеринового альдегида были угаданы верно.
Теперь напишем D-ряд изомерных альдогексоз, полагая, что (+)-глюкоза принадлежит именно к этому ряду. Так поступил Фишер. Не приняв это волюнтаристическое решение, он не смог бы установить строение (+)-глюкозы. В последующем оказалось, (+)-глюкоза действительно относится к D-ряду, к тому ряду, в котором каждый изомер имеет гидроксильную группу при пятом углероде справа

Итак, одна из этих формул принадлежит D-(+)-глюкозе. Какая же? Это было установлено Фишером следующим образом.
1. (-)-Арабиноза, относящаяся к альдопентозам, при окислении азотной кислотой превращается в оптически активную дикарбоновую кислоту. Строение (-)-арабинозы не было известно, однако она могла бы иметь одну из следующих структур D-ряда

Окислим каждую из этих структур азотной кислотой

При рассмотрении строения дикарбоновых кислот видно, что структуры I и III не могут дать оптически активные кислоты. Образующиеся из них дикарбоновые кислоты являются оптически недеятельными мезо-соединениями. Следовательно, арабиноза должна иметь строение II или IV.
2. (-)-Арабиноза при увеличении углеродной цепи превращается в (+)-глюкозу и (+)-маннозу. Поскольку при увеличении цепи альдоз по Килиани-Фишеру образуются эпимеры, то становится понятным, что глюкоза и манноза отличаются друг от друга лишь по конфигурации при втором углеродном атоме. Если (-)-арабиноза имеет строение II, пара эпимеров будет иметь следующее строение

Если для (-)-арабинозы принять структуру IV, то (+)-глюкоза и (+)-манноза будут представлены другими формулами

3. При окислении азотной кислотой и (+)-глюкоза, и (+)-манноза превращаются в оптически активные дикарбоновые кислоты. Окислим соединения V и VI

В результате окисления пары VII и VIII получаться следующие дикарбоновые кислоты

Из рассмотрения молекул дикарбоновых кислот видно, что только продукты окисления пары эпимеров V и VI являются оптически деятельными. При окислении второй пары альдогексоз VII дает оптически неактивную дикарбоновую кислоту, которая представляет собой внутренний рацемат – мезо-соединение.
Таким образом, (+)-глюкоза и (+)-манноза должны иметь строение пары эпимеров V и VI. При этом пока еще остается неизвестным, какая из этих структур принадлежит глюкозе, а какая – маннозе. Однако даже при указанной неопределенности видно, что пара эпимеров V и VI имеют одинаковую конфигурацию при третьем, четвертом и пятом углеродном атомах. Такая же должна быть эта часть молекулы и у (-)-арабинозы, поскольку при увеличении длины цепи по Килиани – Фишеру она без изменения переходит в эпимерную пару глюкоза – манноза. Отсюда следует, что (-)-арабиноза должна иметь конфигурацию IX

4. Дикарбоновая кислота, которая получается при окислении (+)-глюкозы азотной кислотой, образуется и при окислении еще одного моносахарида – (+)-гулозы. Пусть (+)-глюкоза имеет строение V, тогда при окислении получим

Эта же кислота должна получиться и из углевода X, чисто графически произведенного из V путем перестановки альдегидной и концевой оксиметильной групп местами. Однако является ли X другим углеводом, а не просто повернутым на 1800 V? Для ответа на этот вопрос повернем X на 1800, не вынимая формулу из плоскости бумаги (это общее правило манипуляции при работе с проекциями Фишера). Видно, что при этом появляется альдоза L ряда, отличающаяся по строению от глюкозы. Это действительно другая гексоза, которая, тем не менее, при окислении дает ту же самую глюкаровую кислоту, что и (+)-глюкоза. Фишер синтезировал (+)-гулозу и экспериментально подтвердил сказанное.
Таким образом, Фишеру удалось установить конфигурацию при всех четырех хиральных центрах альдогексозы и предложить так называемую линейную формулу (+)-глюкозы. Попутно (!) было установлено строение (-)-арабинозы, (+)-маннозы и (+)-гулозы.
1.2.2. Циклическая структура D-(+)-глюкозы.
Уже к 1895 году накопились некоторые данные, которые не согласовывались с формулой, предложенной для (+)-глюкозы Фишером. - (+)-Глюкоза не вступала в некоторые реакции, «предписываемые» формулой Фишера: не образовывала азометины и не давала производного с бисульфитом натрия. Пентаоксиальдегид должен был бы вступить в указанные реакции за счет альдегидной группы.
- Стало известно о существовании двух глюкоз. Одна из них (т.пл.1460) с удельным вращением в 1120 при растворении в воде постепенно изменяла величину удельного вращения до +52,70. Другая глюкоза с т. пл.1500 и удельным вращением +190 в водном растворе изменяла величину удельного вращения также до значения +52,70 . Первую глюкозу назвали α-D-(+)-глюкозой, а вторую -β-D-(+)-глюкозой. Процесс изменения угла вращения каждого из них до равновесного значения получил название мутаротации.
- Как известно, карбонильные соединения вступают в реакцию ацеталирования. При этом в результате реакции альдегида или кетона с одной молекулой спирта образуется полуацеталь, при взаимодействии с двумя молекулами спирта получается ацеталь

(+)-Глюкоза реагирует лишь с одной молекулой метанола, но то, что получается, скорее относится к ацеталям, чем к полуацеталям. В случае (+)-глюкозы такие производные называются глюкозидами. Их общее название – гликозиды. Связанный с углеводом через кислород остаток называется агликоном. Интересно, что при ацеталировании (+)-глюкозы метанолом в присутствии НСl образуется не один, а два глюкозида. Эти глюкозиды являются невосстанавливающими и неспособны подвергаться мутаротации.
В свете приведенных фактов в формулу Фишера для глюкозы необходимо внести уточнения.
Выше было упомянуто, что карбонильные соединения вступают в межмолекулярную реакцию со спиртами с образованием полуацеталей и ацеталей. (+)-Глюкоза представляет собой пентаоксиальдегид. В этой связи возникает вопрос: а не может ли эта альдогексоза вступить в реакцию внутримолекулярного ацеталирования с участием любой из пяти своих гидроксильных групп? Образующееся при этом соединение будет относиться к полуацеталям циклического строения. С учетом особой устойчивости 5-ти и 6-ти членных циклов можно предположить, что с альдегидной группой глюкозы охотнее будет реагировать гидроксил при четвертом или пятом углероде пентаоксиальдозы. Только в этом случае внутримолекулярное ацеталирование приведет к образование пяти- и шестичленных циклических полуацеталей

Возможность существования D-(+)-глюкозы в циклической форме объясняет факт существования гексозы в виде двух изомеров. В циклической форме глюкозы прежний карбонильный углерод становится хиральным и появляется возможность существования двух конфигурационных изомеров. Такие изомеры, отличающиеся по конфигурации при первом углеродном атоме альдозы, называются аномерами

С учетом существования аномеров находит рациональное объяснение и образование двух глюкозидов при ацеталировании глюкозы метанолом: каждый из аномеров при этом дает свой глюкозид

Исходя из возможности существования глюкозы в виде двух аномеров, легко объясняется и явление мутаротации. В водных растворах аномеры способны взаимопревращаться через открытую форму глюкозы с установлением равновесия между ними

Шестичленный гетероцикл с одним гетероатомом, в качестве которого выступает кислород, называется пираном, пятичленный гетероцикл – фураном

α-D-(+)-глюкозу, имея в виду размер кольца, называют α-D-(+)-глюкопиранозой, а ее аномер -β-D-(+)-глюкопиранозой. Часто при изображении циклической формы глюкозы прибегают к структурам Хеуорса с плоским пирановым кольцом. Однако это кольцо плоским быть не может. Оно более устойчиво в неплоской форме в виде конформации кресла. Встречающиеся в научной литературе циклические формулы аномеров глюкозы даны ниже

Выше мы достаточно подробно рассмотрели циклическую структуру глюкозы. Означает ли это, что глюкозе должна быть придана только циклическая форма? Оказывается, что практически все известные свойства глюкозы описывают только линейная и циклическая формы вместе. Установлено, что они находятся в состоянии равновесия, в котором на долю линейной формы приходится менее 0,5%. Этого достаточно, чтобы глюкоза вступала во многие реакции, характерные для альдегидов (окисление, образование озазона и др.), но недостаточно для осуществления других реакций альдегидов (образование бисульфитного производного, азометинов).
1.2.4. Определение размера кольца (+)-глюкозы.
То, что (+)-глюкоза в циклической форме представляет собой пиранозу, пока еще не доказано. Попытаемся это сделать.
Предположим, что в циклической форме (+)-глюкоза представляет собой пиранозу. Прометилируем, например, один из аномеров -α-D-(+)-глюкопиранозу - диметилсульфатом в щелочной среде. При этом проалкилируются все гидроксильные группы пентаоксиальдегида с образованием метил-α-2,3,4,6-тетра-О-метил-D-глюкозида. В этом соединении гидролизоваться в присутствии кислоты (НС1) способна только эфирная группа, образованная аномерным гидроксилом. Вспомним, что простые эфиры не гидролизуются в отличие от ацеталей. Продукт гидролиза со свободным аномерным гидроксилом - α-2,3,4,6-тетра-О-метил-D-глюкоза находится в равновесии со своей ациклической формой. Все сказанное можно отобразить следующей схемой
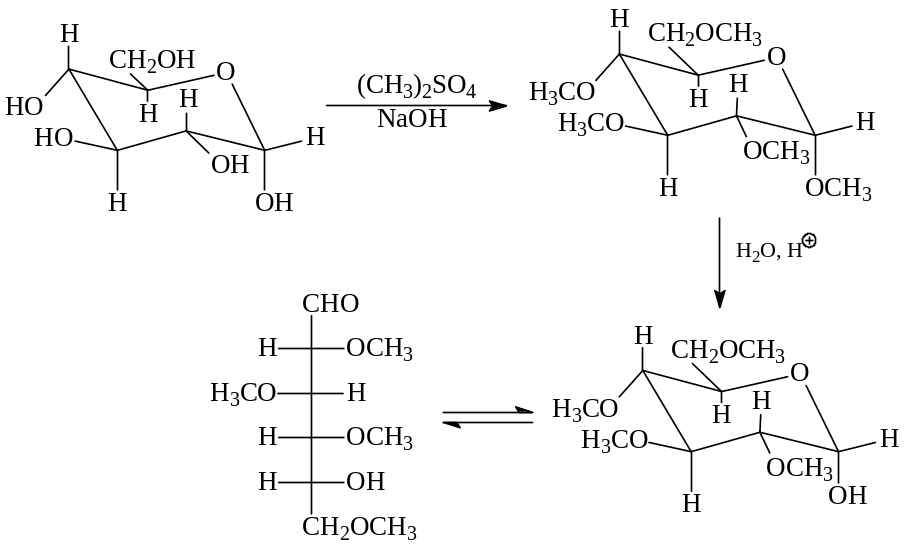
Теперь α-2,3,4,6-тетра-О-метил-D-глюкозу окислим азотной кислотой в жестких условиях. При этом окислению подвергнется альдегидная группа и свободная вторичная гидроксильная при пятом углероде с образованием кетокислоты. Дальше окисляться будет и кетогруппа с разрывом С-С- связей с обеих сторон карбонильной группы. В результате получатся две дикарбоновые кислоты, содержащие пять и четыре углеродных атома

Образование в результате всей цепочки превращений именно триметоксиглутаровой и диметоксиянтарной кислот однозначно свидетельствует в пользу того, что исходная циклическая альдоза содержала шестичленное пиранозное кольцо. При другом размере кольца в конце превращений фигурировали бы иные двухосновные кислоты.
