
- •Конспекты
- •Соединения с открытой цепью
- •I. Углеводороды
- •Номенклатура алканов
- •1.2. Способы получения
- •Химические свойства
- •Алкены (этиленовые углеводороды, олефины)
- •2.1. Строение, изомерия и номенклатура
- •Способы получения
- •Химические свойства
- •Гидратация.
- •3. Галогенирование.
- •4. Гидрогалогенирование.
- •Гипогалогенирование.
- •3. Алкадиены.
- •Методы получения
- •Химические свойства.
- •4. Алкины (ацетиленовые углеводороды).
- •4.1. Методы получения.
- •4.2. Химические свойства.
- •Моногалогенпроизводные алканов.
- •Предельные одноатомные спирты.
- •Многоатомные предельные спирты.
- •Непредельные одноатомные спирты.
- •Альдегиды и кетоны.
- •I. Предельные альдегиды и кетоны.
- •2. Ненасыщенные альдегиды и кетоны.
- •2.1. Оксосоединения с сопряженными двойными связями.
- •2.2. Кетены.
- •3. Диальдегиды и дикетоны.
- •1. Предельные одноосновные кислоты.
- •1.2. Методы получения.
- •1.2. Физические свойства.
- •1.3. Химические свойства.
- •1.3.2. Образование ацилгалогенидов.
- •1.3.3. Образование ангидридов.
- •1.3.4. Этерификация. Сложные эфиры.
- •2. Амины.
- •1.2. Глюкоза.
- •1.3. Другие моносахариды.
- •4.2. Структура целлюлозы.
Многоатомные предельные спирты.
Атомность спиртов определяется числом гидроксильных групп.
2.1. Двухатомные спирты часто называются гликолями. Два гидроксила в молекуле гликоля могут располагаться по отношению к друг другу по разному, однако они не могут находится у одного и того же углерода. Сами такие спирты неустойчивы, однако это не относится к их производным.
Свое название двухатомные спирты с гидроксилами у соседних атомов углерода (виц-диолы) получают от названия этиленовых углеводородов. Например,

По систематической номенклатуре наличие двух гидроксилов у двухатомных спиртов обозначается суффиксом диол с указанием их положения в главной цепи. Так, вышеприведенные спирты по систематической номенклатуре получают следующие названия: этандиол и 1,2-пропандиол.
Гликоли получают с использованием обычных способов введения гидроксила в молекулу: гидроксилирование алкенов (реакция Вагнера), гидролиз дигалогенпроизводных углеводородов и галогенгидринов, гидратацией эпокисей, каталитическим восстановлением сложных эфиров двухосновных кислот и др. Определенное препаративное значение при получении виц-диолов имеет так называемое бимолекулярное восстановление альдегидов и кетонов. Так, восстановление сухого ацетона амальгамированным магнием в бензоле с последующим гидролизом образовавшегося алкоголята магния приводит к пинакону (2,3-диметил-2,3-бутандиолу):

Предполагается, что образованию алкоголята предшествует присоединение магния к двум молекулам ацетона с получением неустойчивого бирадикала.
Аналогично идет реакция бимолекулярного восстановления карбонильных соединений и с амальгамой алюминия.
По своим химическим свойствам диолы повторяют свойства предельных одноатомных спиртов. В то же время в ходе известных реакций с участием двухатомных спиртов наблюдаются свои особенности. Обратим свое внимание как раз на эти особенности.
Аналогично одноатомным спиртам диолы проявляют кислотные свойства. Они у них выражены сильнее, поэтому двухатомные спирты реагируют не только со щелочными металлами с образованием алкоголятов, но и с гидроокисями других металлов с образованием гликолятов, например, комплексно построенного гликолята меди:

Двухатомные спирты с минеральными и органическими кислотами дают полные и неполные сложные эфиры. Известны, например, моно- и диацетаты этиленгликоля:

В случае использовании в реакции двухатомных карбоновых кислот появляется возможность создать полиэфир, который уже будет полимером полиэфирного типа. Сама реакция этерификации в этом случае будет представлять собой частный случай реакций поликонденсации. Один из известных полимеров – лавсан – как раз получают поликонденсацией этиленгликоля терефталевой кислотой (двухосновная кислота ароматического ряда):

Наряду со сложными эфирами диолов существуют также и их полные и неполные простые эфиры. Так, при взаимодействии этилового спирта с окисью этилена образуется моноэтиловый эфир этиленгликоля (этилцеллозольв), прекрасный растворитель при производстве бездымного пороха, ацетатного шелка и других производных целлюлозы:

Известно, что первичные спирты окисляются в альдегиды, а вторичные – в кетоны. Поэтому обычно нетрудно предсказать характер продуктов окисления двухатомных спиртов. Однако имеется вариант окисления, когда вицинальные диолы окисляются с расщеплением углерод-углеродных связей с образованием альдегидов и кетонов. В этом случае окислителем является иодная кислота (Малапраде, 1928 год). Следующие реакции показывают особенности окисления по Малапраде двухатомных спиртов с гидроксилами у соседних атомов углерода:

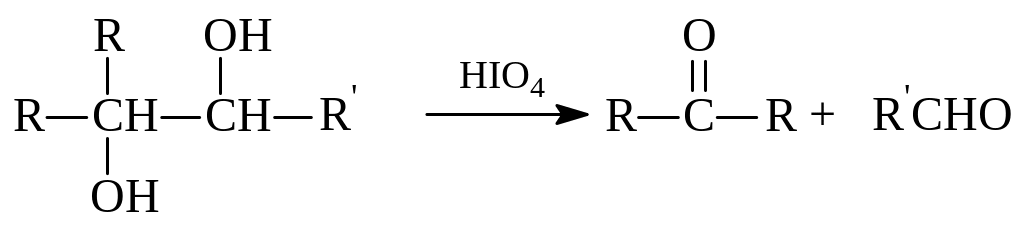
Очень интересно протекает дегидратация двухатомных спиртов в зависимости от взаимного расположения гидроксильных групп. Следующие примеры показывают особенности дегидратации различных диолов:

Кроме того, дегидратация диолов может протекать как межмолекулярный процесс с образованием бифункциональных соединений – спиртоэфиров:
![]()
В свою очередь, спиртоэфиры могут циклодегидратироваться с образованием шестичленных гетероциклов с двумя кислородными атомами в кольце:

Образование р-диоксана наблюдал Фаворский при перегонке этиленгликоля над серной кислотой.
Дегидратация диолов протекает по уже рассмотренному механизму отщепления воды от одноатомных спиртов. Вначале имеет место протонирование молекулы спирта, затем отщепляется вода и образуется карбокатион. В случае дегидратации диолов карбокатион имеет несколько возможностей стабилизации, которые зависят от строения спирта и условий проведения реакции. В ряде случаев карбокатион стабилизируется с выбросом протона и образованием непредельных спиртов: винилового и аллилового:

В других случаях электронодефицитный углерод карбокатиона атакуется имеющимся у него гидроксилом. Таковы случаи образования тетрагидрофурана и р-диоксана:

Наконец, карбокатион может реагировать с внешним нуклеофилом – другой молекулой диола. При этом получается диэтиленгликоль:
![]()
Может быть, наиболее интересно протекает дегидратация двутретичных диолов с гидроксилами у соседних атомов углерода. Так, дегидратация пинакона неожиданно приводит к метилтрет.бутилкетону (пинаколину):

Такое направление реакции легко объясняется в предположении, что первоначально образовавшийся при дегидратации карбокатион в ходе реакции перегруппировывается в более стабильный ион в результате 1,2-метильного сдвига:

Как известно, условием таких перегруппировок является преобразование менее устойчивого карбокатиона в более устойчивый. В данном же случае это условие на первый взгляд не соблюдается: третичный катион перегруппировывается во вторичный. Однако это не просто вторичный карбокатион. В этом катионе электронодефицитный углерод связан с кислородом гидроксильной группы, который эффективно участвует в делокализации положительного заряда. В результате карбокатион, хотя он и только вторичный, однако стабильнее третичного. Рассмотренный случай перегруппировки носит название пинаколиновой.
2.2. Трехатомные спирты – глицерин. Важнейшим представителем трехатомных спиртов является глицерин, с давних времен получающийся гидролизом жиров:

Однако постепенно этот путь получения глицерина перестал удовлетворять спрос на него. Это привело к разработке синтетических методов, лучшим из которых оказался следующий. Вначале аномальным хлорированием пропилена получают хлористый аллил, который гидролизуется в аллиловый спирт. Далее спирт гидроксилируют либо путем гипохлорирования и гидролиза, либо присоединением перекиси водорода:

Глицерин проявляет все свойства, присущие спиртам.
Глицерин при замещении водородов гидроксильных групп на металл легко образует глицераты.
Под действием галогенводородов и галогенидов фосфора глицерин дает галогенгидрины глицерина и 1,2,3-тригалогенпропан. Однако в ходе реакций замещения гидроксила на галоген встречаются некоторые особенности. Так, иодистый водород и трехиодистый фосфор замещают гидроксилы глицерина с образованием 1,2.3-трииодпропана. Однако это соединение в условиях реакции подвергается дальнейшим превращениям. Под действием НI оно превращается в иодистый изопропил, а в реакции с участием РI3 - в иодистый аллил:

Как и другие спирты, глицерин этерифицируется минеральными и карбоновыми кислотами. При этом получаются полные и неполные сложные эфиры. Из них большое значение имеет тринитрат глицерина:

Этот эфир, адсорбированный на кизельгуре (инфузорная земля) или других подходящих сорбентах, используется в виде взрывчатого вещества (динамит, Нобель, 1866 г.). При взрыве тринитрата глицерина выделяются газы, происходит резкое расширение объема и возникает взрывная волна большой разрушительной силы:
![]()
Из сложных эфиров глицерина большое значение приобрели эфиры с о-фталевой кислотой:

Эти эфиры широко используются при приготовлении так называемых глифталевых лаков.
Глицерин в значительных количествах потребляется в химической, пищевой (изготовление кондитерских изделий, ликеров, напитков), текстильной и полиграфической промышленности.
Не выделяя в отдельный раздел, отметим, что применение находят и другие многоатомные спирты, например, пентаэритрит. Его синтезируют исходя из формальдегида и ацетальдегида (см. перекрестную альдольную конденсацию). Эфиры этого спирта используются при производстве синтетических смазочных масел и пластификаторов.
